 Mangan (Mn, łac. Manganum) -jest to pierwiastek chemiczny należący w układzie okresowym do grupy metali przejściowych. Ma 15 izotopów z przedziału mas 49-62 i izomery jądrowe 51 m, 52m, 54m. Trwały jest tylko izotop 55, który stanowi niemal 100% składu izotopowego manganu występującego w naturze.
Mangan (Mn, łac. Manganum) -jest to pierwiastek chemiczny należący w układzie okresowym do grupy metali przejściowych. Ma 15 izotopów z przedziału mas 49-62 i izomery jądrowe 51 m, 52m, 54m. Trwały jest tylko izotop 55, który stanowi niemal 100% składu izotopowego manganu występującego w naturze.
Odmiany alotropowe: Mangan, zależnie od temperatury, przyjmuje cztery formy alotropowe mające różne gęstości:
- <700 °C: odmiana α;
- 700–1079 °C: odmiana β;
- 1079–1143 °C: odmiana γ – dość miękka, łatwo poddaje się obróbce mechanicznej;
- >1143 °C: odmiana δ.
Odkrycie Manganu: Sole i tlenki manganu były stosowane już w starożytności. Dawni hutnicy używali w procesie dymarkowym do wyrobu żelaza m.in. rudy darniowej zawierającej związki fosforu i manganu. We wczesnym średniowieczu wysoki stopień opanowania procesu dymarskiego cechował na obszarze Barbaricum głównie celtyckie ośrodki kulturowe.
(...) żelaza, podobną trochę do grubo zmielonej kawy.
Grubość takiego złoża jest zwykle niewielka - od kilku centymetrów do najwyżej 1 m. Ruda ma postać pylistą lub gruzełkowatą, a czasami tworzy twarde, lite płyty o powierzchni do kilkudziesięciu metrów kwadratowych. Jeśli nie ma rudy pod darnią, można jej poszukać w zakolach rzeki, gdzie nurt wyraźnie zwalnia, lub w kieszeniach na zboczach doliny, którą płynie rzeka. Dobrą wskazówką obecności rudy darniowej jest czerwonobrunatne zabarwienie gleby, kretowisk oraz wody w zastoiskach.
Ten typ rudy żelaza występuje na terenie naszego kraju właściwie wszędzie: na Mazowszu, Podlasiu, Mazurach, w Wielkopolsce i w setkach innych miejsc. Polskie zasoby ocenia się aż na 535 tys. t, mimo wielowiekowej eksploatacji i zniszczenia wielu złóż przez meliorację.
Złoża te powstały niedawno - w okresach ocieplenia między kolejnymi zlodowaceniami. Było wtedy wilgotno, a woda jest niezbędna do utworzenia rudy. Przepływając przez osady zawierające związki żelaza, rozpuszcza je. Żelazo przechodzi do roztworu i jest unoszone dalej, aż zmieniające się warunki zewnętrzne spowodują jego wytrącenie w postaci bardzo drobnej zawiesiny tlenków i wodorotlenków. Woda transportuje delikatną zawiesinę, dopóki nie trafi w spokojne miejsce, gdzie może ona opaść. Może to być podmokła łąka lub inne miejsce, gdzie gromadzi się stagnująca woda bagno, staw, podgórskie torfowisko. W miarę upływu czasu żelazisty osad ulega kolejnym przeobrażeniom. Traci wodę i staje się coraz bardziej zbity i twardy - mówiąc potocznie, kamienieje, a naukowo - ulega lityfikacji. Powstaje ruda żelaza. Rudy darniowe różnią się jednak od wszystkich znanych kopalin - złoża te odnawiają się, i to bardzo szybko. Wystarczy odczekać kilka lat i... hokus-pokus - znów można je eksploatować. By było to możliwe, trzeba jednak dokładnie po sobie posprzątać. Przykryć wyeksploatowane złoże darnią, przywrócić przepływ wód. Należy również poczekać, aż odnowi się roślinność i flora bakteryjna gleby. Krótko mówiąc, trzeba przeprowadzić rekultywację złoża.
Właściwość ta od dawna budziła zdziwienie badaczy - siedemnastowieczny przyrodnik i lekarz Jan Jonston pisał: "W Żaganiu, na Śląsku, żelazo odradza się w ciągu dziewięciu lat i na nowo się je wykopuje w tym czasie". Lecz znane są jeszcze krótsze okresy odnowienia złoża - nawet jednoroczne.
(...) Tlenki manganu wywołują również barwienie szkła na fioletowo, i mogą w zależności od atmosfery wytopu pełnić rolę odbarwiacza. Najstarsze przykłady celtyckich produktów szklanych pojawiają się około 250-220 r. p.n.e., w tym również na terytorium Polski.
Pierwszą osobą, która zasugerowała istnienie tego pierwiastka był Carl Wilhelm Scheele, w 1774 r. przesłał on próbki piroluzytu (braunsztynu) do Johana Gottlieb Gahna, który w tym samym roku jako pierwszy wyizolował metaliczny mangan. Dokonał tego poprzez wymieszanie próbki z ropą naftową i prażenie w tyglu węglowym. W uproszczeniu można zapisać, że mangan powstał przez redukcję zawartego w próbkach dwutlenku manganu węglem:
- MnO2 + 2C → Mn + 2CO.
- Leksykon Przyrodniczy. Minerały i kamienie szlachetne. Horyzont, 2002.
- O. Medenbach, C. Sussieck-Fornefeld: Minerały. Świat Książki, 1996.
- R. Hochleitner: Minerały i kryształy. Muza, 1994.
- J. Bauer: Przewodnik Skały i minerały. Multico, 1997.
- Kazimierz Maślankiewicz: Kamienie szlachetne. Wyd. 3 poprawione i uzupełnione. Warszawa: Wydawnictwo Geologiczne, 1982.
- N. Sobczak: Mała encyklopedia kamieni szlachetnych i ozdobnych. Alfa, 1986.
- Skład
- 10% chromu (Cr), ok. 2% manganu (Mn) i 88% niklu (Ni).
*Występowanie manganu w skorupie ziemskiej:
Występuje w skorupie ziemskiej w ilości 850 – 1000 ppm, w znacznej części w postaci rud składających się z jego tlenków, węglanów i krzemianów. Jest po żelazie najbardziej rozpowszechnionym metalem ciężkim. W światowym wydobyciu manganu (w przeliczeniu na czysty składnik), wynoszącym w 2001 r. 9 mln ton, przodowały: Chiny (2,5 mln ton), RPA (1,5 mln ton), Ukraina (1,2 mln ton), Australia (1,1 mln ton) i Brazylia (1,1 mln ton).
Ważniejsze minerały to: piroluzyt, psylomelan, manganit, braunit, hausmanit, dialogit, rodonit i bementyt.
Bibliografia:
*Znaczenie biologiczne: Mangan obecny jest w centrach reaktywności wielu enzymów i jest niezbędnym do życia mikroelementem. Zalecane spożycie manganu dla osób dorosłych wynosi 1,6 mg, nadmiar może sprzyjać rozwojowi demencji, schizofrenii oraz pogłębiać chorobę Parkinsona, niedobór zaś, choć bardzo rzadki, powoduje opóźnienie w rozwoju fizycznym.
Fragment: -> "A Review of the Catalytic Mechanism of Human Manganese Superoxide Dismutase" - Jahaun Azadmanesh; Glora E. O. Borgstahl.
Kompleksy manganu są wykorzystywane w mechanizmie fosforylacji niecyklicznej fotosystemu II fotosyntezy u roślin – bierze udział w fotolizie wody (rozkładzie wody przez działanie światła).
 |
| Źródło: mdpi.com |
FRAGMENT: "Structural models of the biological oxygen-evolving complex: achievements, insights, and challenges for biomimicry" - Satadal Paul, Frank Neese and Dimitrios A. Pantazis - Kompleks tlenowy (OEC) w fotosystemie II (PS-II) tlenowej fotosyntezy katalizuje utlenianie wody do dioksygenu, protonów i elektronów, co jest reakcją, która stanowi podstawę energii słonecznej do konwersji energii chemicznej w biosferze. Nieorganiczny rdzeń OEC to klaster o budowie okso, który zawiera cztery Mn i jedno jony Ca, Mn 4 CaO 5. Rozszyfrowanie struktury tego klastra i jego bezpośredniego otoczenia było celem intensywnych wysiłków eksperymentalnych, które obejmowały dziesięciolecia badań. Ciągle poprawiająca się strukturalna definicja OEC w ciągu ostatnich piętnastu lat dała możliwości lepszego zrozumienia jej właściwości i funkcji; zapewnia również coraz jaśniejsze i lepiej zdefiniowane cele w zakresie biomimetycznej chemii syntetycznej. Poniżej przedstawiamy krytyczny przegląd najnowszych osiągnięć w molekularnych modelach strukturalnych OEC, koncentrując się głównie na udanych próbach badawczych zgłoszonych po dostępności atomowo rozdzielonych modeli krystalograficznych PS-II. Wyznaczamy właściwości, które zostały ukierunkowane w badaniach biomimetycznych i przeanalizujemy, które aspekty strukturalne zostały odtworzone w systemach syntetycznych. W połączeniu z dogłębnymi badaniami teoretycznymi dostępność nowych syntetycznych analogów strukturalnych doprowadziła do znacznego wglądu w korelacje struktura-właściwości pomimo braku aktywności katalitycznej. Niemniej jednak istnieją ważne cechy OEC, które pozostają niedostępne dla chemii syntetycznej. Głównymi z nich są unikalny rodzaj ograniczonej elastyczności strukturalnej oraz wysoce uporządkowana i stabilna sfera ligandu, która umożliwia ściśle kontrolowane współdziałanie geometrii, stanu spinu i reaktywności, które są cechami charakterystycznymi OEC.
Wprowadzenie
Kompleks, w którym powstaje tlen (OEC) systemu Photosystem II (PS-II), dzieli wodę na dioksygen, protony i elektrony, generując ekwiwalenty redukujące i gradient protonowy, który napędza resztę fotosyntezy w cyjanobakteriach, algach i roślinach. 1-6 Ogromny wysiłek został skierowany na syntezę modeli nieorganicznego rdzenia OEC. 7-21 Replikacja strukturalnych i elektronicznych właściwości naturalnego układu w syntetycznych analogach pozwoliłaby nam uzyskać wgląd w właściwości i funkcję samego katalizatora biologicznego, a także zrozumieć, w jaki sposób pewne aspekty strukturalne i elektroniczne mogą odnosić się do aktywności, jak częścią większego napędu w kierunku rozwoju sztucznej fotosyntezy. 22-30 OEC zawiera Mn4 skupiskaCaO 5 , 31 , 32 często omawiane w kategoriach jednostki Mn 3 CaO 4 połączonej z wiszącym czwartym manganem przezjeden z mostów okso jednostki i dodatkowy mostek bis-μ-okso ( ryc. 1a ). Jony metali są skoordynowane głównie z ligandami karboksylowymi (łańcuchami bocznymi asparaginianu i reszt glutaminianu), jedną histydyną i czterema cząsteczkami wody lub ligandami pochodzącymi z wody.Ditlenku ewolucja jest ostatnim etapem w cyklu katalitycznym zawierającym różnych metastabilnych utlenienia znane jako S ı stanów, gdzie indeks wskazuje, że liczba zapisanych równoważników utleniającym ( Fig. 1b ). 33-38Napędzane przez foto-wywołane ładowania rozdzielania na chlorofili centrum reakcji PS II, cykle OEC z S 0 stanu z poszczególnych manganu utlenienia Mn ( III ), +3 Mn (IV ), za pomocą szeregu reakcji utleniania metalu wyśrodkowany na All-Mn ( IV ), S 3 stan; czwarty utleniania, który może być lub może nie być metalowe skoncentrowane prowadzi do przejściowej S 4stanu, który rozwija O 2 i resetuje Katalizator S 0 .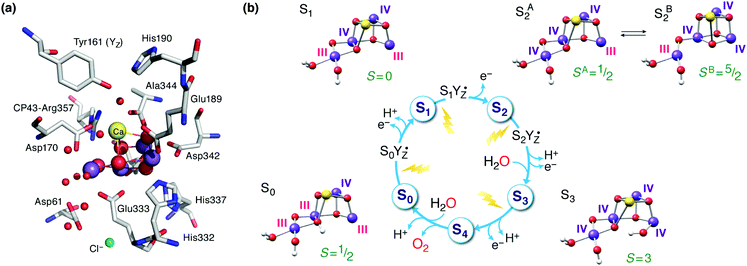 | ||
| Ryc. 1 (a) Klaster manganowo-wapniowy kompleksu wydzielającego tlen i jego środowiska białkowego. 41 Patrz Rys. 2b dla schematu i oznakowania rdzenia nieorganicznego. (b) Cykl stanów S i ze strukturalnymi, indywidualnymi stanami utlenienia Mn i całkowitymi przypisaniami stanu spinu. 42 | ||
Nawet powyższy pobieżny strukturalny opis OEC jest w rzeczywistości połączonym produktem ogromnych wysiłków badawczych prowadzonych na arenie międzynarodowej przez wiele lat. Na przykład, chociaż różne elementy konstrukcyjne OEC były znane od dawna i techniki od EXAFS do EPR spektroskopii dostarczyły ważnych informacji na temat możliwych rozmieszczeń jonów metali, pierwszy model krystalograficzny PS-II pojawił się tylko w 2001. 39W latach 80. i 90. skład pierwiastkowy i fakt, że jony manganu powinny być dostatecznie blisko i magnetycznie oddziałujące, a więc co najmniej częściowo połączone w niepewnej topologii przez niepewną liczbę mostków tlenowych i / lub karboksylowych, w dużym stopniu podsumowały dostępne informacje. o strukturze OEC. W tym czasie hipotezy dotyczące struktury OEC były stymulowane przez cząsteczki, które zostały zsyntetyzowane i scharakteryzowane strukturalnie, tj.dostępność jakiegokolwiek określonego wzorca łączności zainspirowałaby spekulacje na temat tego, czy ten wzór może naśladować OEC. Ten okres czasu dla syntetycznej chemii nieorganicznej charakteryzował się brakiem specyficznych ukierunkowanych motywów strukturalnych: topologia jądra OEC była nieznana, więc nie było ukierunkowanych wysiłków w kierunku syntetycznego celu strukturalnego. Dokonując przeglądu literatury z tego okresu, można by usprawiedliwić wrażenie, że każda cząsteczka zawierająca więcej niż jeden Mn może być uważana za potencjalną symfonię OEC. Odnośnie sugestii co do struktury samej OEC, brak konkretnych danych strukturalnych za krąŜącymi wówczas pomysłami skłonił Wieghardta do scharakteryzowania dostępnych wówczas modeli jako "estetycznej kombinacji faktów doświadczalnych, przemyślanego wnioskowania,40
W ten sposób uzyskano ważną i piękną chemię, która znacznie wzbogaca bibliotekę kompleksów manganu, zwłaszcza związków oligonukleinowych. Wczesne prace syntetyczne obejmowały kompleksy oksymetryczne o mieszanych walorach dimerycznych manganu i stopniowo rozszerzano je, aby uzyskać skuteczne przygotowanie i charakteryzację kompleksów manganu o różnej nuklearności, składzie i architekturze. Kompleksy manganowe tego czasu i uzyskane z nich spostrzeżenia zostały gruntownie przeanalizowane. 7,10,40,43,44 Głównym celem niniejszego przeglądu będą raczej najnowsze osiągnięcia i wysiłki syntetyczne, które były wyraźnie kierowane przez zorientowane na strukturę podejście biomimetyczne inspirowane nowoczesną wiedzą na temat topologii OEC.
Era krystalografii białek została zainaugurowana w 2001 roku przez pierwszy dyfraktogram rentgenowski PS-II. 39 Model o niskiej rozdzielczości (3,8 Ł) nie mógł zaoferować atomistycznego modelu rdzenia nieorganicznego, ale po raz pierwszy wyglądało na to, że struktura OEC była w zasięgu. Ważny kamień milowy został osiągnięty w 2004 r. Dzięki modelowi Ferreiry i wsp. Wrozdzielczości 3,5 Å . , 45 znany bardziej potocznie jako "model londyński". Dało to pierwszą, niekompletną, ale śmiało specyficzną sugestię dotyczącą topologii nieorganicznego rdzenia, proponującą obecność podjednostki cubo Mn 3 CaO 4 z czwartym jonem Mn przyłączonym do jednego z czterech mostków O w kostce ( ryc. 2a)). Tak więc model londyński dostarczył jasnego i dobrze zdefiniowanego celu dla strukturalnej chemii biomimetycznej, ale także stał się podstawą szeregu badań obliczeniowych. 46-50 Widmo krystalograficzne na OEC zostało udoskonalone przez "model berliński" o rozdzielczości 3,0 Å 51, który zapewnia lepszy widok na bezpośrednie otoczenie klastra i został włączony z wielkim sukcesem w mechanistyczne badania Siegbahna. 52-54 Badania EXAFS dostarczyły cennych informacji na temat odległości międzymetalicznych i dały początek licznym interpretacjom strukturalnym, ale bez konwergencji do zgodnych modeli trójwymiarowych. 36,55-64 Pierwszy model OEC atomowej rozdzielczości (1,9 A) został zgłoszony w 2011 r. Przez Umena et al. 41Model ten ustanowił współczesny obraz rdzenia nieorganicznego z pięcioma mostkami okso i zmienioną łącznością w porównaniu do oryginalnej Ferreiry i wsp. model ( ryc. 2b ). Mimo to, rozdzielczość 1,95 modelu, który jest wolny od promieniowania-uszkodzenia 64-67 i może być bezpiecznie nadana głównie 42,68,69 S 1 stan UKE została opisana w 2015 roku tylko 70
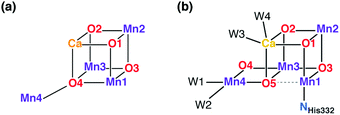 | ||
| Rys. 2 Schematyczny schemat połączeń modelu londyńskiego dla rdzenia OEC (a) 45 i aktualnego modelu dla klastra Mn 4 CaO 5 (b). 41,70 | ||
Zainspirowany modelem krystalograficznym z 2011 r. 41, oszałamiająca ilość kolejnych badań eksperymentalnych i teoretycznych (zbyt wiele do zilustrowania tutaj) zaczęła go udoskonalać i uwzględniać dodatkowe strukturalne i elektroniczne aspekty OEC w różnych stanach S i . Góry osiągnięciem wglądu strukturalnego interpretacja strukturalny 2012 z dwóch różnych dobrze znanych EPR sygnałów S 2 Stanu (wielowierszowego sygnał na g około 2, wynikające z podziału S = 1/2 stanu i sygnał na g ≥ 4.1 wynikający ze stanu S = 5/2) pod względem walencyjnych postaci izomerycznych rdzenia nieorganicznego, które różnią się łącznością okso-mostu. 71Te dwie formy są wzajemnie przekształcalne poprzez przesunięcie wiązania środkowego mostu O5: forma o wysokim spinie (S B 2 na ryc. 1b ) zawiera "zamknięty" Mn 3 CaO 4 cubane z pięcioma współrzędnymi zwisającymi Mn ( III ), podczas gdy w formie niskiego spinu (S A 2 ) kubańczyk jest "otwierany" przez obecność zniekształconego pięciokoordynacyjnego jonu Mn ( III ) Jahn-Tellera w miejscu Mn1 (patrz Fig. 2b w celu oznakowania) , powodując w zamian przegrupowanie wiązania i tworzenie wiązania Mn4-O5. 71-73 Pojawienie się topologii o wysokim spinie zamkniętym kubańskim w S 2stan został zaproponowany jako istotny z punktu widzenia mechaniki w późniejszym postępie katalitycznym. 6,74-78 Istnieje dość szeroka zbieżność opinii na temat topologii stanów S 0 , S 1 i S 2 (przedstawionych na ryc. 1b ) wynikających z wielu ostatnich badań, ale szczegóły S 2 -S 3 przejście i dokładny charakter państwa S 3 pozostają pod aktywnym śledztwem. 74,77,79-98 Jest zasadniczo nie strukturalny informacji o stanach obok S 3 , a tym samym identyfikacji S 4 i pośrednich związanych z tworzeniem ditlenku i uwalniania pozostaje przedmiotem dyskusji.99–103
Punkt, który jest ważny, aby wyjaśnić od samego początku, ponieważ jest bardzo istotny dla niniejszego przeglądu, dotyczy precyzyjnej topologii wiązania w rdzeniu nieorganicznym. Opis klastra w postaci modelu "3 + 1" do rozmieszczenia jonów Mn (topologia uwzględniona już w mnogości możliwych interpretacji danych EXAFS przez długi czas 55 ) jest ściśle związana z analizą S 2stanowy wielowierszowy sygnał EPR Britt i współpracowników. 104 Z pozoru analogiczny opis gromady w kategoriach prostopadłościennej jednostki Mn 3 Ca z dodatkiem oksymetrycznym oraz jonu "danglerowego" Mn odzwierciedla oryginalny model londyńskiego rdzenia nieorganicznego ( ryc. 2a)), ale ściśle mówiąc, ta terminologia nie jest całkowicie odpowiednia dla obecnych modeli OEC - przynajmniej nie dla łączności w niższych stanach S i . Innymi słowy, (wciąż aktualny w większości przypadków) opis 105,106 "trimer-monomer" opis topologii magnetycznej OEC i "kubański-dangler" opis struktury geometrycznej nie są ani synonimami, ani jednakowymi. Poza tym jest oczywiste z podstawowych modeli pokazanych na ryc. 1b, że rdzeń nieorganiczny na ogół niezawiera "właściwego", w pełni związanego Mn 3 CaO 4kubańskie w większości obserwowalnych stanów. Ten punkt okaże się ważny w dyskusji na temat obecnych modeli syntetycznych.
Przyglądając się wysiłkom chemików syntetycznych, aby stworzyć strukturalne odpowiedniki OEC, dobrze jest zachować powyższą ewolucję idei strukturalnych i modeli, ponieważ przez długi czas wysiłki te były inspirowane modelami, które ostatecznie okazały się niedokładne lub tylko znaczenie pośrednie dla obecnego szczegółowego widoku OEC. Pecoraro i Hsieh odpowiednio zauważyli w tym punkcie: "czasami wydaje się, że nic w badaniach fotosyntetycznych nie wytrzymuje próby czasu ...". 9W obecnym przeglądzie chcemy przedstawić krytyczną perspektywę najnowszej ewolucji geometrii, struktury elektronowej i powiązanych właściwości syntetycznych systemów z ostatnich postępów w kierunku udoskonalonych strukturalnych naśladowców OEC. W tym momencie nie ma zbieżności analogii strukturalnych i zdolności utleniania wody w modelach syntetycznych. Oznacza to, że istniejące kompleksy Mn, które wiązały się z wydzielaniem tlenu, zasadniczo nie przypominają OEC pod względem struktury geometrycznej. Ponadto czasami nie jest jasne, czy takie kompleksy są oryginalnymi katalizatorami molekularnymi 107-109, czy też wydzielanie dioksanu zawsze można przypisać prawdziwemu utlenianiu wody. 110-112Biorąc pod uwagę, że takie nie-biomimetyczne systemy oparte na manganie i ich chemia zostały obszernie przeanalizowane w najnowszej literaturze, 18-21,113-116, nie będziemy ich tu omawiać. Podobnie, nie będziemy zajmować się systemami heterogenicznymi, 17 117-121, chociaż należy zauważyć, że specyficzne motywy strukturalne związane z OEC mogą występować w tlenkach Mn lub Mn / Ca. 17,122
Naszym punktem wyjścia jest seria syntetycznych gromad tetramanganowych. W pierwszym pokoleniu okso-zmostkowane tetramanganese klastrów przedstawienie systemu przechodzi do oxomanganese cubanes zawierające wapń i oznaczenie struktur gdzie piąty jonów jest przyłączony do MN 3 jednostki Ca. Dzięki charakterystyce eksperymentalnej i znacznemu wkładowi chemii teoretycznej wiele z tych strukturalnych analogów OEC już wniosło znaczący wgląd w właściwości systemu biologicznego.
Ukierunkowane cechy strukturalne
Zanim przejdziemy dalej, warto podkreślić kilka istotnych właściwości OEC, które służą jako indywidualne lub kombinowane cele dla strukturalnej chemii biomimetycznej. Obejmują one:
• Stechiometria czterech manganu i jednego jonu wapnia.
• Inkorporacja Ca 2+ w szkielecie metalowym z mostkami okso.
• Mn 3 CaO 4 podbudowy, które mogą lub nie mogą być obecne w postaci w pełni połączonego urządzenia, w niektórych S I stanowi, w zależności od stopnia utlenienia Mn.
• Czwarty jon Mn ("dangler Mn") zewnętrzny względem powyższej jednostki prostopadłościennej, połączony z nim za pomocą mostków okso.
• Prawie wyłącznie ligandy karboksylowe i pochodne wody.
• Poza powyższymi cechami strukturalnymi model powinien zawierać fizjologicznie odpowiednie stany utleniania jonów Mn (wyłącznie III i IV) 42, a struktura ligandów w idealnych warunkach wspiera dostęp do wielu stanów utlenienia.
Wszystkie powyższe cechy strukturalne mają ważne implikacje dla struktury elektronowej klastra, jego właściwości magnetycznych i spektroskopowych, a ostatecznie dla jego funkcji katalitycznej, chociaż te ostatnie nie mogą być sensownie rozpatrywane w oderwaniu od matrycy białkowej OEC i reszty maszyny PS-II.
Przegląd modeli syntetycznych
Kompleksy tetramanganowe
Najpierw chcielibyśmy przedstawić kilka tetranuklearnych kompleksów Mn, które były historycznie ważne w biomimetycznej syntetycznej chemii, chociaż większość z nich nie byłaby dziś uznawana za bezpośrednie naśladownictwo OEC. Różnorodność układów ze stopniem utlenienia metalu w zakresie od Mn ( II ) 4 do Mn ( IV ) 4 przenika literaturę chemii tetranuclear manganu. Recenzje na temat tetranuclear Mn-oxo clusters zapewniają klasyfikację pod względem powszechnie obserwowanych i strukturalnie różnych wzorów pokazanych na ryc. 3 . 710,123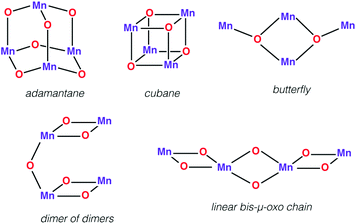 | ||
| Ryc. 3 Reprezentatywne topologie klastrów tetramanganowych z mostkami okso. | ||
Jednym z najwcześniejszych modeli z motywem tetramanganu był adrenantan Mn ( IV ) 4 O 6 4+stabilizowany trzema ligandami chelatującymi 1,4,7-triazacyklonanowymi ( ryc. 4a ). 124 Zespół Wieghardta i współpracowników wykazuje słabe oddziaływanie ferromagnetyczne pomiędzy jonami Mn, które zmieniają się na słaby antyferromagnetyczny po protonowaniu, jak zaobserwował Hagen i in. 125 Podobny kompleks tetranuklearny o kształcie adamantanu został zgłoszony przez Armstronga i współpracowników. 126
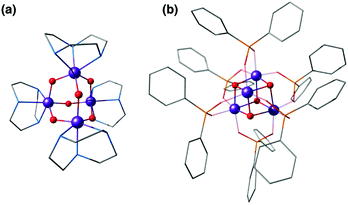 | ||
| Rys. 4 Mn 4 O 6 kompleks adamantanu autorstwa Wieghardta i współpracowników 124 (a) i Mn 4 O 4cubane complex autorstwa Dismukes i wsp. 127 (b). | ||
Mn 4 (μ 3 -O) 4 cubane rdzeń jest jednym z wczesnych propozycje konstrukcji GKW w różnych S Istanów cyklu katalitycznego. 128129 prostopadłościennych układ jonów manganu został osiągnięty przez Christou i wsp który syntetyzuje zniekształcony cubane ze stechiometrii [Mn ( III ), +3 Mn ( IV ), (ľ 3 -O) 3 X] 6+ (X = Cl lub Br). 43, 130-132 Magnetochemia ujawniła wysoki poziom spinu ( S = 9/2) z dobrze odseparowanymi stanami wzbudzonymi wynikającymi z oddziaływania antyferromagnetycznego pomiędzy unikalnym Mn ( IV) i trzech sprzężonych ferromagnetycznie jonów Mn ( III ), 132-134, podczas gdy prawie równoległe wyrównanie trzech osi Jahn-Tellera jonów Mn ( III ) prowadzi do silnej anizotropii magnetycznej. 133,134 Widma EPR w niskiej temperaturze w paśmie X wykazały dwa zestawy sygnałów, szeroki pik przy g ≈ 6 i inny dobrze rozdzielony 16-liniowy sygnał z 55 Mn nadsubtelną strukturą wyśrodkowaną przy g ≈ 2, przypominającą dwa sygnały EPR w S 2 stan OEC.131,135
W ciągu następnych latach analogiczne związki z różnych ligandów zaciskowe (Cl - , pirydyny, acetyloacetoniany, dibenzoilometanu, itp .) I anionowego jj 3 X pozycji (X = I - CL - Br - F - , OAc - , OH - , OMe - , OPh - , NO 3 - , N 3 - i NCO - ) dodatkowo rozszerzyły tę klasę kompleksów. 131,134,136-143Niektóre z nich, na przykład związek zgłoszony przez Wanga i in. , okazało się również naśladować S 1Do S 2, etapie utleniania. 142
Kompleks Dismukes i współpracownicy opisali złożony kompleks Mn ( III ) 2 Mn ( IV ) 2 all-μ-oxo 2cubane ( ryc. 4b ). 127,144-146 Pomimo, że różne gatunki walentną związek Mn 4 O 4 L 6 (L = Ph 2 PO 2 - ) wykazywały prawie równoważne długości wiązań Mn O, który został przypisany do wartościowości delokalizacji w podwyższonej temperaturze (298 ° K ). Obniżenie temperatury do 150 K prowadziło do niewielkiego zróżnicowania wiązań Mn-O 147 i wykazano, że równoważność długości wiązania zależy od ligandu L. 148,149Struktura krystaliczna pojedynczo produkt utleniania kompleksu [Mn 4 O 4 ] 7+ wykazuje trójkątny zakłócenia w porównaniu do tetragonalnej symetrii zespołu dominującego, czyli [Mn 4 O 4 ] 6+ . 150 W tej postaci utlenionej Mn ( III ), Mn ( IV ), +3 rozkład wartościowość przypisano jony manganu, chociaż nie istotne zniekształcenie osiowy czworokątny obserwuje Mn ( III ). Podobny Mn 4 O 4 cubane z dwoma Mn ( III ) i dwoma Mn ( IV) został przygotowany przez Kanady i in. 151 Ekscytującą cechą cubane Dismukes jest to, że można go poddawać zdjęciem przegrupowania z wytworzeniem O 2 i diarylphosphinate ligand i ostatecznie rozpada się do produktu w kształcie motyla ( fig. 5 ). Koncepcja rewersywnego przegrupowania cubane / butterfly była w rzeczywistości jednym z wczesnych proponowanych mechanizmów dla cyklu katalitycznego OEC, a struktura w kształcie motyla była jednym z sugerowanych modeli strukturalnych dla niższych stanów S i . 129 152 Teoretyczne badania opisują strukturę elektronową i właściwości magnetyczne tych kompleksów, a także możliwe ścieżki powstawania dioksygenów. 153-155
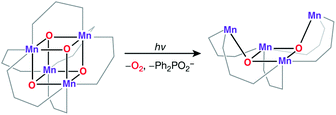 | ||
| Ryc. 5 Fotoindukowane otwarcie kubizmu Dismukesa do rdzenia motyla. | ||
Innym przykładem typu motylkowego kompleksu serii [Mn 4 (μ 3 = O) 2 (μ-O 2 , CR) 7 (bpy) 2 ], +(R = Me, Et, Ph), obejmujących stany utlenienia spośród Mn ( II ) 2 Mn ( III ), 2 do Mn ( III ) 4 , który zawiera niepłaską Mn 4 urządzenie z dwoma atomami Mn tworząc centralną Mn 2 o 2 diament rdzenia i dwie inne jony manganu w reakcję ligacji ze okso mosty ( ryc. 6 ). 156.157Obecność dwóch typów odległości Mn-Mn w OEC wywnioskowanej z EXAFS, przy ok . 2,7 Å i 3,3 Å, 40 spełnia kompleks w kształcie motyla, który zawiera dwie różne odległości Mn-Mn wynoszące 2,85 Å i 3,30 Å. Wiele podobnie ukształtowanych klasterów tetranuklearnych zsyntetyzowano z dwukleszczowymi ligandami chelatującymi. 136,140,158-164 Należy zauważyć, że bez obecności co najmniej jednego Mn ( IV) takie kompleksy nie odpowiadają żadnemu z stanów fizjologicznych OEC.
------
DZIAŁANIE FOTOSYSTEMU II:
*Abros – nazwa stopu odznaczającego się dość dużym oporem elektrycznym oraz odpornością na czynniki zewnętrzne (np. korozję).
Stop ten wykorzystywany jest m.in. do produkcji elementów grzejnych.
*Aludur – stop aluminium z krzemem i manganem. Cechuje się wysoką odpornością na korozję. W związku z tym wykorzystuje się go przy produkcji przewodów linii wysokiego napięcia i innych elementów konstrukcyjnych, które bywają narażone na złe warunki eksploatacji.
*Hydronalium – stop aluminium zawierający 2–5% magnezu i 0,1–0,4% manganu do obróbki plastycznej. Charakteryzuje się dobrą odpornością na korozję powodowaną wodą morską, stąd jego zastosowanie w przemyśle okrętowym i chemicznym.
*Manganin – stop miedzi z manganem i niklem. Charakteryzuje się bardzo małym współczynnikiem temperaturowym oporu elektrycznego. Stosowany do produkcji oporników wzorcowych i precyzyjnych, a także połączeń elektrycznych w urządzeniach kriogenicznych[1]. Zawiera zwykle 86% miedzi, 12% manganu i 2% niklu ( Cu86/Mn12/Ni2 ).
*Supermaloj (Supermalloy) – stop niklu (79%), żelaza (15,5-16%), molibdenu (5%) i manganu (0-0,5%).
Supermaloj jest materiałem magnetycznie miękkim (do jego rozmagnesowania wystarcza pole około 0,3 A/m), o dużej przenikalności magnetycznej (początkowa 125 000, maksymalna 900 000), i stosunkowo małej indukcji nasycenia (0,8 T)[1].
Znajduje zastosowanie jedynie przy niskich częstotliwościach w urządzeniach energetycznych, takich jak: transformatory, silniki, prądnice, cewki o dużej indukcyjności.
ZWIĄZKI MANGANU:
a) Manganiany:
a) Nieorganiczne sole manganu (II):












































































Brak komentarzy:
Prześlij komentarz