Odkrycie:
Został odkryty i wyodrębniony w 1807 roku przez sir H. Davy’ego. Jako pierwszy polską nazwę „potas” zaproponował Filip Walter.
Występowanie, izotopy: Główne minerały w których występuje potas to sylwin, karnalit, kainit, langbeinit i różne glinokrzemiany. Trwałe izotopy to 39K oraz 41K. Ważnym nietrwałym izotopem jest słabo promieniotwórczy 40K, z którego, zależnie od sposobu przemiany, powstaje 40Ar lub 40Ca. Pierwsza z tych przemian wykorzystywana jest do datowania skał i minerałów metodą potasowo-argonową.
- Metoda potasowo-argonowa (K-Ar) – metoda stosowana do datowania skał o wieku setek tysięcy lub milionów lat. Została opracowana w latach pięćdziesiątych XX wieku. Dopuszczalny błąd chronologiczny tej metody wynosi maksymalnie 10%[potrzebny przypis].Metoda ta jest również stosowana do datowania stanowisk wczesnych hominidów w Afryce, pochodzących sprzed blisko 5 milionów lat[potrzebny przypis]. W przypadku skał wulkanicznych można nią datować tylko te, których wiek przekracza 100 000 lat[potrzebny przypis].
Podstawowe założenia metody
Datowanie to, podobnie jak metoda radiowęglowa, opiera się na zjawisku rozpadu promieniotwórczego.W tym wypadku chodzi o bardzo powolny, lecz stały rozpad promieniotwórczego izotopu potasu 40K do postaci trwałego gazowego izotopu argonu 40Ar w skałach wulkanicznych. Znając szybkość rozpadu 40K (jego czas połowicznego zaniku wynosi ok. 1,26 miliarda lat) i zmierzywszy ilość 40Ar uwięzionego w próbce skał o określonej masie, uzyskujemy szacunkową datę ich formowania się.Bardziej czuły wariant tej metody, zadowalający się jeszcze mniejszą próbką, znany jest jako datowanie za pomocą fuzji laserowej argon-argon. Trwały izotop potasu 39K jest przekształcany w 39Ar w drodze bombardowania próbki, którą chcemy wydatować, strumieniem neutronów. Ilość obu izotopów argonu może być następnie zmierzona, po ich uwolnieniu w wyniku fuzji laserowej, przez spektrometr masowy.Ponieważ proporcja 40K do 39K w skałach jest stała, wiek znaleziska może być określony na podstawie proporcji 40Ar do 39Ar. Jak przy wszystkich radiometrycznych metodach datowania, istotne jest wykrycie czynnika ustawiającego zegar archeologiczny w pozycji zerowej. W tym przypadku byłoby to uformowanie się skały w wyniku aktywności wulkanicznej, uwalniającej cały znajdujący się tam wcześniej argon.Niektóre obszary, najważniejsze dla badań dolnego paleolitu, a zwłaszcza Wielki Rów Wschodni w Afryce, to rejony aktywności wulkanicznej. Oznacza to, że pozostałości archeologiczne znajdują się często w warstwach geologicznych powstałych w wyniku działalności wulkanicznej, a zatem nadających się do datowania tą metodą. Dodatkowo są one często przykryte przez porównywalne skały wulkaniczne, a więc daty takich dwóch warstw geologicznych wyznaczają granice chronologiczne dla zawartego między nimi złoża archeologicznego.W tej metodzie mierzy się zawartość argonu 40Ar powstałego z rozpadu jądra potasu 40K. W obliczeniach zakłada się, że cały rejestrowany argon zawarty w minerale powstał po zastygnięciu skały. Jest to warunek niezbędny.Ograniczenia
Rezultaty datowania metodą argonowo-potasową obciążone są błędem szacunkowym (tak samo, jak w przypadku innych metod radiometrycznych). Główne ograniczenie tej techniki polega na tym, że może być użyta jedynie do datowania znalezisk przykrytych przez skałę wulkaniczną, oraz że rzadko za jej pomocą udaje się osiągnąć dokładność wyższą niż ±10%. Niemniej metoda ta stała się kluczowym narzędziem na obszarach, gdzie występuje odpowiedni materiał wulkaniczny.Nie ma metody, która pozwalałaby zmierzyć początkową zawartość argonu 40Ar przed i tuż po zastygnięciu skały. Radioaktywny argon 40Ar powstały z rozpadu potasu 40K zawartego w skałach jest nie do odróżnienia od argonu 40Ar pochodzenia atmosferycznego.W czasie rozpadu potasu 40K nie mogą występować żadne czynniki zakłócające. Problem polega na tym, że skały mają zdolność absorpcji argonu. Argon 40Ar nawet w normalnych (niezmiennych) warunkach może przenikać do otaczającej go wody lub być wypłukiwany przez wodę, w której jest rozpuszczalny. Nie istnieje metoda, która bezsprzecznie pozwoli ocenić czy warunki rozpadu potasu 40K nie ulegały zmianie i jaki wpływ na zawartość argonu 40Ar w skale miała woda.Przed zastygnięciem materiału skalnego, gdy jest on w stanie płynnym, argon do pewnego stopnia ulatnia się. Ale jednocześnie istnieje możliwość zaabsorbowania przez skały tego gazu z atmosfery.
Charakterystyka potasu: Potas jest bardzo miękkim metalem. Można go kroić nożem , niczym ser.Jest bardzo aktywnym pierwiastkiem, potencjał standardowy układu K+/K wynosi −2,93 V. W kontakcie z wodą i kwasami zapala się i często wybucha. Reaguje z alkoholami, wypierając z nich wodór, przy czym tworzą się alkoholany. O ile jego powierzchnia nie jest spasywowana(na powietrzu pokrywa się warstwą nadtlenku K2O2), w kontakcie z powietrzem może się zapalić. Przechowuje się go w nafcie lub oleju parafinowym (najlepiej pod warstwą argonu).
Ważne związki potasu to tlenek potasu, nadtlenek potasu, wodorotlenek potasu, będący bardzo silną zasadą oraz wiele soli. Prawie wszystkie sole potasu są dobrze rozpuszczalne w wodzie. Do trudno rozpuszczalnych soli potasu należą: nadchloran (KClO4), heksachloroplatynian(IV) (K2[PtCl6]) oraz wodorowinian (KHC4H4O6).
Potas, podobnie jak sód, wykazuje chemiluminescencję – podczas powolnego utleniania tlenem atmosferycznym jest widoczne delikatne świecenie.
 |
| Źródło: thoughtco.com - Violet flame - - fioletowa barwa płomienia spowodowana jest obecnością jonów K+. |
Kationy K+ należą do V grupy kationów i barwią płomień na kolor różowo-fioletowy.
Znaczenie biologiczne potasu:
- bierze udział w przewodzeniu impulsów przez neuron
- podwyższa stopień uwodnienia koloidów komórkowych
- aktywator wielu enzymów
Niedobór u człowieka powoduje:
- osłabienie organizmu
- zmniejszenie kurczliwości mięśnia sercowego
- osłabienie mięśni szkieletowych i gładkich
Niedobór u roślin powoduje:
- chlorozę liści
- zwiędły pokrój rośliny
- zahamowanie wzrostu korzenia, pędu
- martwicę organów
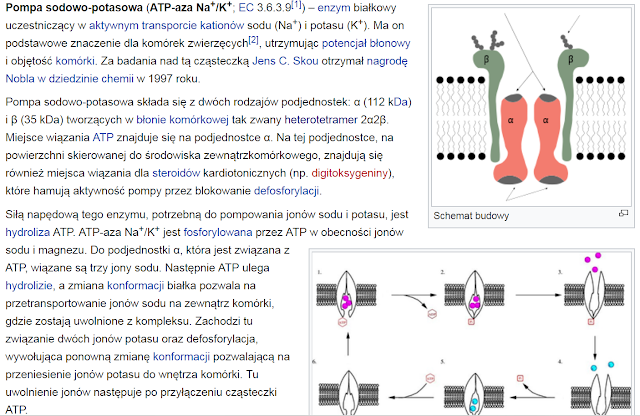
Kationy potasu są głównymi jonami wewnątrzkomórkowymi, koniecznymi do utrzymania potencjału czynnościowego błon komórkowych (patrz: znaczenie biologiczne pierwiastków).
*Zagadnienia związane z pierwiastkiem potasu:
| Porażenie okresowe | |||
| |||
Hiperkaliemiczne porażenie okresowe (choroba Gamstorp, ang. hyperkalemic periodic paralysis, HYPP, Gamstorp episodic adynamy) – choroba genetyczna z grupy kanałopatii, spowodowana mutacją w genie kanału sodowego SCN4A w locus 17q23.1-q25.3. Dziedziczona jest autosomalnie dominująco. Objawia się napadami osłabienia mięśni, z początkiem w 1. i 2. dekadzie życia, trwającymi od 30 minut do kilku godzin. W rozpoznaniu stosuje się często test wysiłkowy, prowokujący objawy. Chorobę opisała Ingrid Gamstorp w 1956 roku[1].
Choroba występuje znacznie częściej u koni niż u ludzi; objawy i patomechanizm są te same[2].
Leczenie
Leczenie może polegać na podawaniu[3]:
- glukozy i węglowodanów;
- diuretyków takich jak: tiazydy, furosemidy i acetazolamidy;
- dożylnie glukozy i insuliny.
Nawozy potasowe – nawozy mineralne których głównym składnikiem jest potas w formie kationu K+, będący makroskładnikiem pokarmowym dla roślin, niezbędny w międzymembranowym transporcie elektronów podczas asymilacji dwutlenku węgla (CO2) oraz pośrednio do biosyntezy związków organicznych – sumarycznie jego niedobór powoduje mniejsze wytwarzanie cukrów (monosacharydów i w efekcie skrobi).
Nawozami potasowymi są wypłukiwane i suszone sole mineralne głównie chlorek potasu z minerału sylwin lub kainit (nawóz potasowo-magnezowy), saletra indyjska (azotan potasu, 45–46% K2O, 12% N2), , ewentualnie produkty z ich przerobu, jak np. kalimagnezja.
Wśród nawozów potasowych możemy wydzielić:
- chlorkowe, stosowane dla roślin niewrażliwych na nadmiar chloru, gdzie potas występuje w postaci chlorku potasu (KCl), np. kainit (8–10% K2O), sole potasowe;
- siarczanowe, tu potas występuje w postaci siarczanu potasu, może je stosować dla wszystkich roślin, np. kalimagnezja (26–30% K2Onawóz potasowo-magnezowy);
Nawozy potasowe dzieli się również na nisko- i wysokoprocentowe (32–51% K2O), np. sole potasowe, siarczan potasu, metafosforan potasu.
W Polsce gleby zazwyczaj są ubogie w ten składnik pokarmowy, wprowadza się go zwykle w postaci nawozów wieloskładnikowych (nawozy potasowo-magnezowe można zaliczyć do nawozów potasowych).
*Związki potasu:
a) Nieorganiczne sole potasu:
| |||
| |||
| |||
| Ogólne informacje | |||
| Wzór sumaryczny | KBrO 3 | ||
| Masa molowa | 167,00 g/mol | ||
| Wygląd | biały lub prawie biały, granulowany proszek lub kryształy[1] | ||
| |||
| Identyfikacja | |||
| Numer CAS | 7758-01-2 | ||
| PubChem | 24444[2] | ||
| |||
| |||
| Podobne związki | |||
| Inne aniony | KClO 3, KIO 3, KBrO, KBrO 2, KBrO 4 | ||
| Inne kationy | LiBrO 3, NaBrO 3, RbBrO 3, CsBrO 3 | ||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||
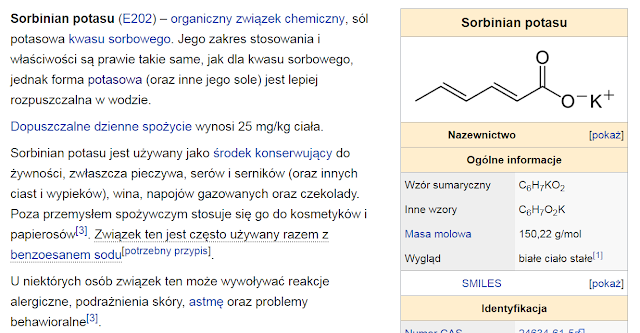
Bromian potasu (nazwa Stocka: bromian(V) potasu), E924, KBrO
3 – nieorganiczny związek chemiczny z grupy bromianów, sól kwasu bromowego i potasu. Stosowany w żywności jako u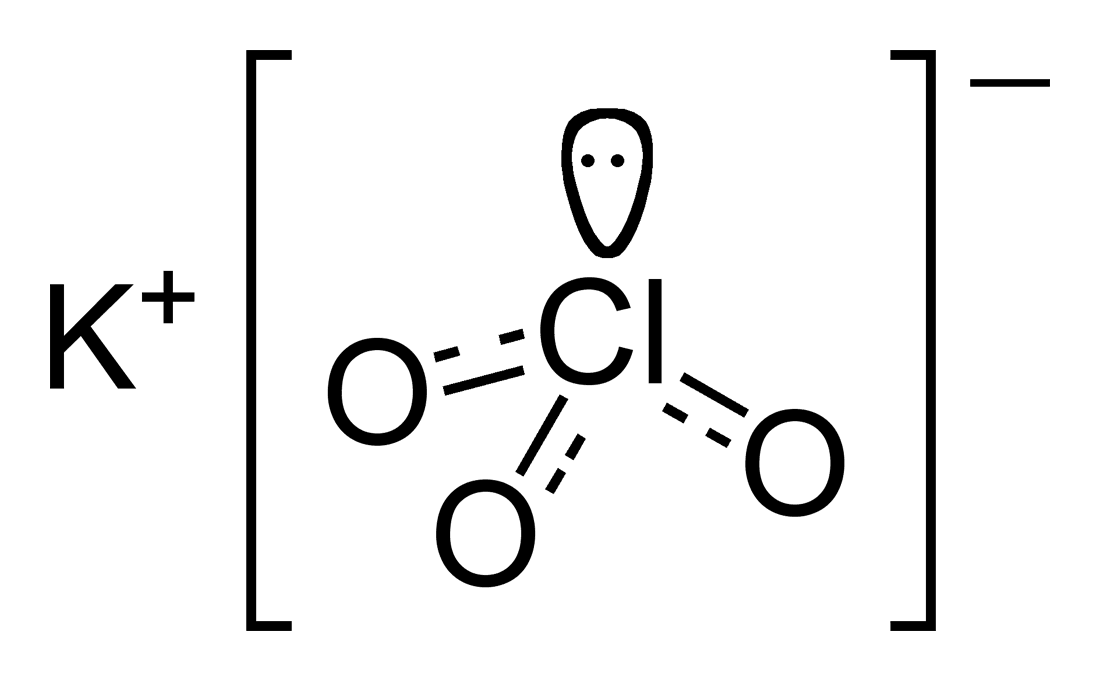 le
le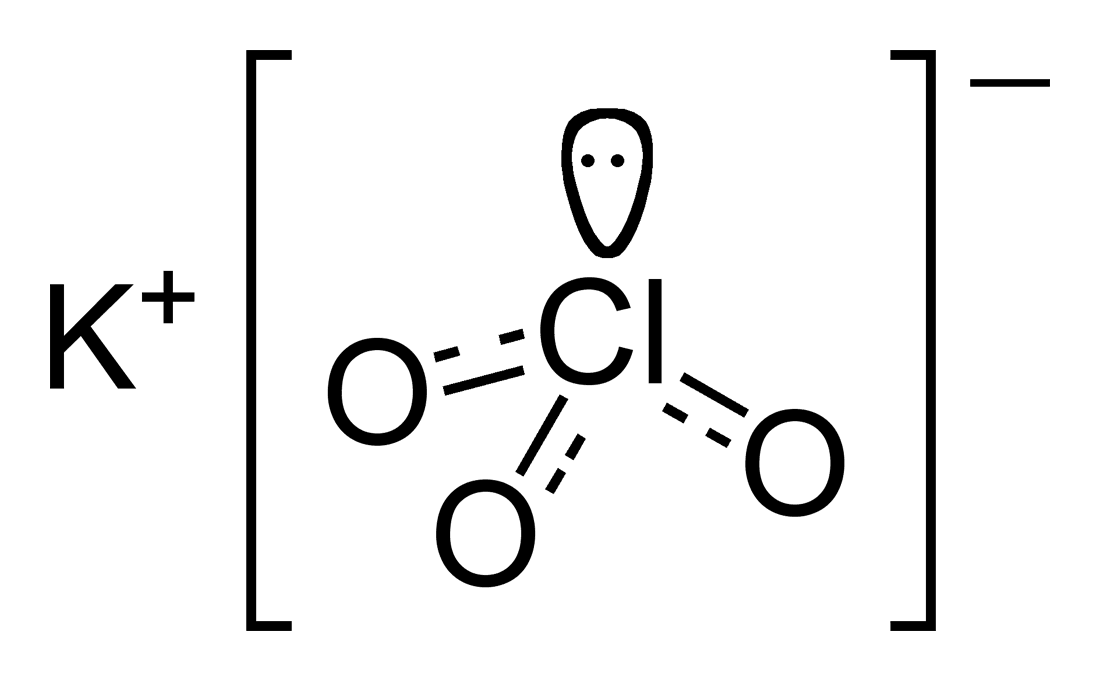 pszacz.
pszacz.
3 – nieorganiczny związek chemiczny z grupy bromianów, sól kwasu bromowego i potasu. Stosowany w żywności jako u
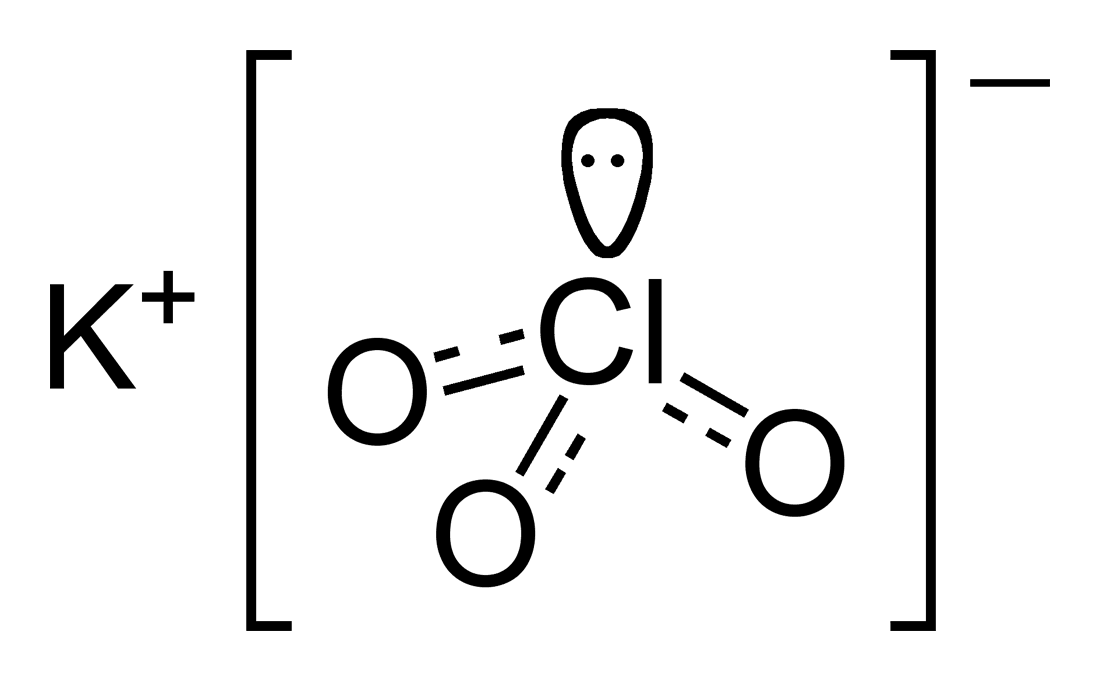 le
le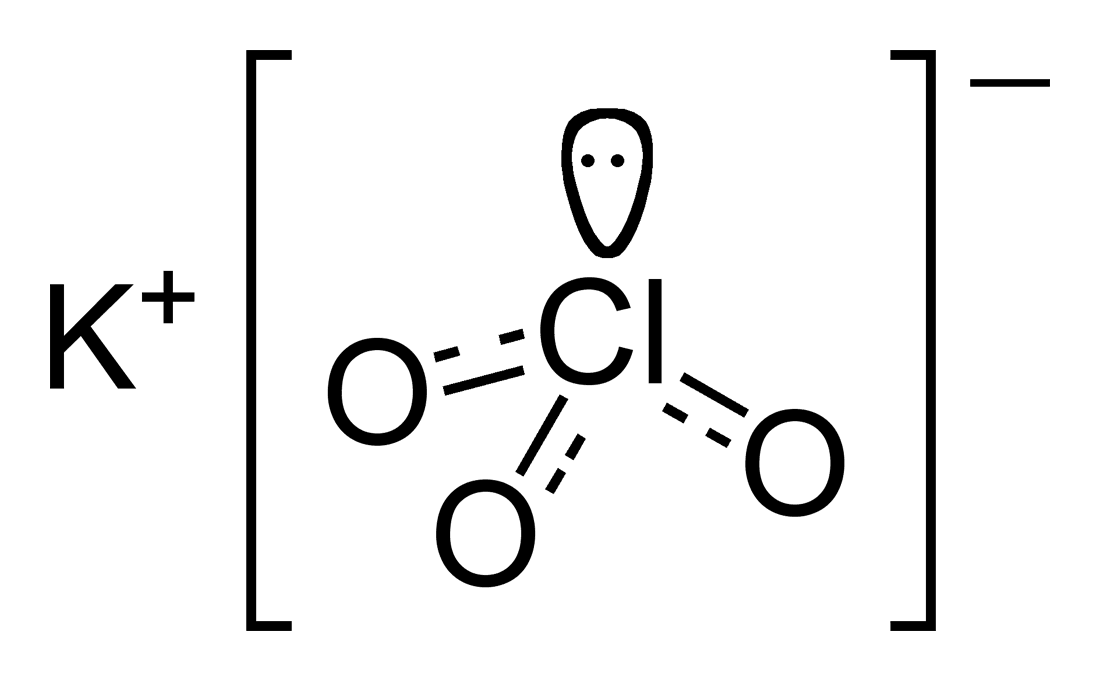 pszacz.
pszacz.Otrzymywanie[edytuj | edytuj kod]
Na niewielką skalę bromian potasu jest wytwarzany przez wprowadzenie bromu do roztworu wodorotlenku potasu[6]:
- 6KOH + 3Br
2 → KBrO
3 + 5KBr + 3H
2O
Do produkcji na skalę przemysłową wykorzystuje się odpowiednie procesy elektrolityczne, np. utlenianie elektrolityczne wodnego roztworu bromku potasu z dodatkiem chromianu potasowego[6]:
- KBr + 3H
2O → KBrO
3 + 3H
2↑
Elektrolizę prowadzi się w temperaturze 35–45 °C na elektrodach z blachy platynowej z gęstością prądu w zakresie 10–20 A/dm². Podczas elektrolizy wytrąca się trudno rozpuszczalny bromian potasowy.
Można także uzyskiwać go jako produkt uboczny przy produkcji bromku potasu wytwarzanego poprzez absorpcję bromu z wody morskiej w węglanie potasu[potrzebny przypis].
 Chloran potasu, KClO3 (nazwa Stocka: chloran(V) potasu) – nieorganiczny związek chemiczny, sól potasowa kwasu chlorowego. Stosowany do produkcji zapałek i materiałów wybuchowych[7].
Chloran potasu, KClO3 (nazwa Stocka: chloran(V) potasu) – nieorganiczny związek chemiczny, sól potasowa kwasu chlorowego. Stosowany do produkcji zapałek i materiałów wybuchowych[7].Otrzymywanie[edytuj | edytuj kod]
Na skalę przemysłową otrzymywany jest czasami w procesie elektrolizy roztworu chlorku potasu. W przestrzeni anodowej zachodzą następujące reakcje[8]:
- 2Cl− → Cl2 + 2e−
- Cl2 + H2O ⇌ HClO + H+ + Cl−
- HClO ⇌ H+ + ClO−
- 2HClO + ClO− → ClO−3 + 2Cl− + 2H+
Anody do tego procesu pokrywane są powłokami z RuO2 lub tytanu, aby zapewnić ich trwałość chemiczną.
W analogicznym procesie elektrochemicznym częściej otrzymuje się chloran sodu (jako roztwór wodny), z którego następnie wytrąca się chloran potasu po dodaniu stałego KCl[8]:
- KCl + NaClO3 → NaCl + KClO3↓
Jest to główna przemysłowa metoda produkcji tego związku. Pozostała solanka jest zawracana do elektrolizera i wykorzystywana ponownie[8].
Inną metodą otrzymywania KClO3 jest przepuszczanie gazowego chloru przez gorący roztwór wodorotlenku potasu[9]:
- 3Cl2 + 6KOH → KClO3 + 5KCl + 3H2O
- b) Organiczne sole potasu:
- *Rubid (Rb, łac. Rubidium) - jest to pierwiastek chemiczny z
- Występowanie: Występuje w skorupie ziemskiej w ilości 90 ppm. Minerałami o
- ↑ Wartość w nawiasie oznacza niepewność związaną z ostatnią cyfrą znaczącą. Znane są próbki geologiczne, w których pierwiastek ten ma skład izotopowy odbiegający od występującego w większości źródeł naturalnych. Masa atomowa pierwiastka w tych próbkach może więc różnić się od podanej w stopniu większym niż wskazana niepewność.
- 1Otrzymywanie
- 2Zastosowanie
- 3Zagrożenia
- 4Przypisy
- Rb
2O(s) + H2O(l) → 2RbOH_{(aq)}
grupy metali alkalicznych układu okresowego.
 Charakterystyka: Rubid ma 29 izotopów z przedziału mas 74–102 o okresie półtrwania minimum 1 ms. Trwały jest tylko 85Rb. W naturalnym składzie izotopowym tego pierwiastka oprócz 85Rb (72,2%) występuje jeszcze długożyciowy izotop 87Rb (27,8%, t1/2 ≈ 50 mld lat).W postaci czystej rubid jest bardzo miękkim, ciągliwym metalem o srebrzysto-szarym połysku. Jego własności chemiczne są zbliżone do potasu (który jest mniej reaktywny od rubidu) oraz cezu (który jest bardziej reaktywny). Jest drugim po cezie najbardziej elektrododatnim z nieradioaktywnych metali alkalicznych (X = 0,82). Topi się w temperaturze 39,3 °C. Tworzy amalgamat z rtęcią oraz stopy ze złotem, żelazem, cezem, sodem i potasem, ale nie z litem. Na powietrzu zapala się samorzutnie, z wodą reaguje wybuchowo. Ma bardzo małą energię jonizacji, 406 kJ/mol.
Charakterystyka: Rubid ma 29 izotopów z przedziału mas 74–102 o okresie półtrwania minimum 1 ms. Trwały jest tylko 85Rb. W naturalnym składzie izotopowym tego pierwiastka oprócz 85Rb (72,2%) występuje jeszcze długożyciowy izotop 87Rb (27,8%, t1/2 ≈ 50 mld lat).W postaci czystej rubid jest bardzo miękkim, ciągliwym metalem o srebrzysto-szarym połysku. Jego własności chemiczne są zbliżone do potasu (który jest mniej reaktywny od rubidu) oraz cezu (który jest bardziej reaktywny). Jest drugim po cezie najbardziej elektrododatnim z nieradioaktywnych metali alkalicznych (X = 0,82). Topi się w temperaturze 39,3 °C. Tworzy amalgamat z rtęcią oraz stopy ze złotem, żelazem, cezem, sodem i potasem, ale nie z litem. Na powietrzu zapala się samorzutnie, z wodą reaguje wybuchowo. Ma bardzo małą energię jonizacji, 406 kJ/mol.
Kationy Rb+ barwią płomień na kolor fioletowo-różowy. Odróżnienie od bardzo podobnej barwy płomienia potasu wymaga spektroskopu.
relatywnie wysokiej zawartości rubidu są lepidolit i karnalit.
Odkrycie:
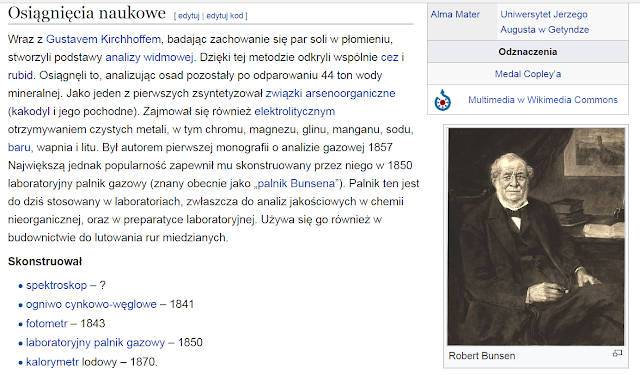
Został odkryty w roku 1861 r. przez R. Bunsena i G. Kirchhoffa, w Heidelbergu, w Niemczech. Robert Bunsen otrzymał rubid po raz pierwszy w postaci czystej za pomocą reakcji chlorku rubidu z potasem.
Znaczenie biologiczne rubidu: Niektóre sole rubidu, podobnie jak sole litu, mają działanie stymulujące ośrodkowy układ nerwowy. Dawniej podejmowano próby zastosowania soli rubidu w lecznictwie psychiatrycznym (w chorobie afektywnej).
izotop 87Rb (27,8%, t1/2 ≈ 50 mld lat)[6].
W postaci czystej rubid jest bardzo miękkim, ciągliwym metalem o srebrzysto-szarym połysku[7]. Jego własności chemiczne są zbliżone do potasu (który jest mniej reaktywny od rubidu) oraz cezu (który jest bardziej reaktywny). Jest drugim po cezie najbardziej elektrododatnim z nieradioaktywnych metali alkalicznych (X = 0,82). Topi się w temperaturze 39,3 °C. Tworzy amalgamat z rtęcią oraz stopy ze złotem, żelazem, cezem, sodem i potasem, ale nie z litem[8]. Na powietrzu zapala się samorzutnie, z wodą reaguje wybuchowo[7]. Ma bardzo małą energię jonizacji, 406 kJ/mol[9].
Kationy Rb+ barwią płomień na kolor fioletowo-różowy. Odróżnienie od bardzo podobnej barwy płomienia potasu wymaga spektroskopu.
Występowanie[edytuj | edytuj kod]
Występuje w skorupie ziemskiej w ilości 90 ppm. Minerałami o relatywnie wysokiej zawartości rubidu są lepidolit i karnalit.
Odkrycie[edytuj | edytuj kod]
Został odkryty w roku 1861 r. przez R. Bunsena i G. Kirchhoffa, w Heidelbergu, w Niemczech. Robert Bunsen otrzymał rubid po raz pierwszy w postaci czystej za pomocą reakcji chlorku rubidu z potasem.
Znaczenie biologiczne[edytuj | edytuj kod]
Niektóre jego sole, podobnie jak sole litu, mają działanie stymulujące ośrodkowy układ nerwowy. Dawniej podejmowano próby zastosowania soli rubidu w lecznictwie psychiatrycznym (w chorobie afektywnej)[10].
Zastosowania techniczne
Znane są jego tlenki, sole kwasów nieorganicznych i kilkaset kompleksów metaloorganicznych, jednak żaden z tych związków nie odgrywa praktycznej roli.
W roku 1995 izotop 87Rb został wykorzystany do uzyskania kondensatu Bosego-Einsteina.
Stosowany jest w niewielkich ilościach jako domieszka do półprzewodnikówstosowanych w fotokomórkach, dodatek do specjalnych gatunków szkła oraz jako komponent zegarów atomowych.
Uwagi
Datowanie rubidowo-strontowe - metoda datowania bezwzględnego ze względu na bardzo długi czas rozpadu izotopurubidu (wynosi on około 48,6 mld lat) W tej metodzie Rb87 zamienia się w Sr87. Metoda ta jest użyteczna do datowania skał magmowych i osadowych o wieku ponad 100 mln lat.
Związki rubidu:
| |||
| |||
| Ogólne informacje | |||
| Wzór sumaryczny | RbOH | ||
| Masa molowa | 102,48 g/mol | ||
| Wygląd | szarobiałe, higroskopijnekryształy | ||
| |||
| Identyfikacja | |||
| Numer CAS | 1310-82-3 | ||
| PubChem | 62393[1] | ||
| |||
| |||
| |||
| Podobne związki | |||
| Inne aniony | tlenek rubidu | ||
| Inne kationy | woda amoniakalna, wodorotlenek magnezu, wodorotlenek wapnia, wodorotlenek sodu | ||
| Podobne związki | wodorotlenek potasu, wodorotlenek cezu | ||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||
Wodorotlenek rubidu, RbOH – nieorganiczny związek chemiczny z grupy wodorotlenków. Jest to bardzo silna zasada, silniejsza od wodorotlenku sodu i wodorotlenku potasu, ale słabsza od wodorotlenku cezu. Związek ten nie występuje w naturze.
Spis treści
[ukryj]Otrzymywanie
Wodorotlenek rubidu może być otrzymany w reakcji tlenku rubidu z wodą:
Wodorotlenek rubidu jest także dostępny na rynku w postaci 50 lub 90% roztworu wodnego.
Zastosowanie
Wodorotlenek rubidu jest rzadko używany w procesach przemysłowych, ponieważ wodorotlenek sodu i wodorotlenek potasu spełniają te same funkcje w mniej gwałtowny, i co za tym idzie bezpieczniejszy, sposób. Wodorotlenek rubidu znajduje zastosowanie w badaniach naukowych, jest jednak często używany oszczędnie, żeby zapobiec marnowaniu drogiego rubidu.
Pomimo że wodorotlenek rubidu jest rzadko używany w normalnych procesach przemysłowych otrzymywanie większości związków rubidu odbywa się z użyciem wodorotlenku jako produktu przejściowego. Wszystkie te syntezy zaczynają się od tlenku rubidu, który w pierwszym etapie jest dodawany do wody.
Zagrożenia
Wodorotlenek rubidu jest żrącym związkiem, który powoduje natychmiastowe oparzenia skóry. Przy pracy z tym związkiem należy stosować ubranie ochronne wykonane z materiałów odpornych na działanie silnych zasad. Roztwory tego związku należy rozcieńczać przez ostrożne wlewanie ich do wody, a nie poprzez dodawanie wody do nich, aby uniknąć popryskania. Większość reakcji z udziałem wodorotlenku rubidu ma charakter silnie egzotermiczny, co może powodować pożary i pienienie się mieszanin reakcyjnych.
Charakterystyka: Jest jednym z najbardziej reaktywnych pierwiastków, na powietrzu bardzo szybko pokrywa się ciemnym nalotem (tlenku cezu), z wodą i kwasami reaguje wybuchowo. Fluorek cezu (CsF) jest jednym ze związków o najwyższym udziale wiązania jonowego (92%). Cez w reakcji ze złotem daje jonowy złotek cezu (CsAu), który rozkłada się w kontakcie z wodą na złoto i wodorotlenek cezu.
Odkrycie: Cez został odkryty w 1860 r. przez Roberta Bunsena i Gustava Kirchhoffa podczas spektroskopowego badania wody mineralnej pochodzącej z Dürkheim w Niemczech.
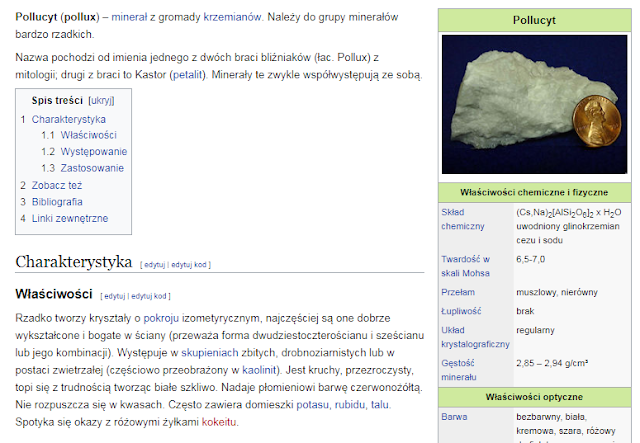
Występowanie: Minerałem o relatywnie wysokiej zawartości cezu jest pollucyt lub inaczej polluks (CsAlSi2O6). Cez występuje w skorupie ziemskiej w ilości 0,3 ppm (liczba atomów) tj. 1,9 ppm wagowo.
Izotopy: W przyrodzie występuje w postaci jedynego (z 40 znanych w roku 2003) trwałego izotopu 133Cs. Najpowszechniejszy pośród radioaktywnych izotopów cezu jest 137Cs, stanowiący produkt rozszczepienia, i tym samym występujący w opadzie radioaktywnym i wypalonym paliwie jądrowym. Po 131I stanowi drugi najliczniej uwalniany radioizotop w przypadku awarii reaktorów jądrowych, pomijając gazy szlachetne. Stanowi zagrożenie dla zdrowia, ponieważ wykazuje chemiczne podobieństwo do potasu, przez co wbudowuje się w cały organizm człowieka, ze szczególnym uwzględnieniem śledziony, wątroby i mięśni. Dopuszczalna roczna dawka pochłonięta doustnie została określona przez EPA na 3,7 MBq.
137Cs występuje w równowadze promieniotwórczej ze swoim produktem rozpadu, 137Ba. Produkują one promieniowanie beta o energii 512 keV i gamma, o energii 662 keV.
Nuklidy 137Cs i 137Ba są często wykorzystywane w przemyśle (radiografia) oraz w badaniach geofizycznych (sonda γ - γ), gdyż dają jedną silną linię promieniowania γ o energii 662 keV.
Związki cezu:
















































































































Brak komentarzy:
Prześlij komentarz