*Borowce - są to pierwiastki chemiczne należące do 13 (daw. IIIA lub III głównej) grupy układu okresowego. Do borowców zaliczamy: bor - półmetal, metale: glin, gal, ind i tal oraz otrzymany w ilości kilkuatomowej nihonium. Na powłoce walencyjnej borowców znajdują się 3 elektrony walencyjne.
 1) Bor (B, łac. borium) - pierwiastek chemiczny o liczbie atomowej 5, półmetalz bloku p układu okresowego.
1) Bor (B, łac. borium) - pierwiastek chemiczny o liczbie atomowej 5, półmetalz bloku p układu okresowego.
Charakterystyka: Bor pod względem chemicznym przypomina krzem i węgiel, gdyż tworzy borowodory – analogi węglowodorów i krzemowodorów. Reakcja boru z gorącym, stężonym kwasem azotowym prowadzi do utworzenia kwasu borowego H3BO3. Bor tworzy kompleksy z alkoholami polihydroksylowymi, reakcja kwasu borowego z mannitolem jest jednym ze sposobów oznaczania zawartości boru w próbce.
Odmiany alotropowe: Bor posiada dwie odmiany alotropowe: bor amorficzny - posiadający kolor brązowy i bor krystaliczny - czarny, bardzo twardy (twardość 9.3 w skali Mohsa, jest słabym przewodnikiem prądu elektrycznego).
 2) Glin (w technice: aluminium; Al, łac. aluminium) - jest to pierwiastek chemiczny, metal z bloku p układu okresowego. Jedynym izotopem stabilnym jest 27Al. Glin jest trzecim najpowszechniej występującym pierwiastkiem w skorupie ziemskiej. Od jego symbolu (oraz symbolu krzemu) wywodzi się dawna nazwa najbardziej zewnętrznej warstwy globu – sial.
2) Glin (w technice: aluminium; Al, łac. aluminium) - jest to pierwiastek chemiczny, metal z bloku p układu okresowego. Jedynym izotopem stabilnym jest 27Al. Glin jest trzecim najpowszechniej występującym pierwiastkiem w skorupie ziemskiej. Od jego symbolu (oraz symbolu krzemu) wywodzi się dawna nazwa najbardziej zewnętrznej warstwy globu – sial.
Historia: Sole i tlenki glinu znane były od zarania dziejów. Uwodniony, mieszany siarczan tego pierwiastka, ałun, był używany jako środek antyseptyczny przez Starożytnych Greków.
2Al + 6HCl → 2AlCl
3 + 3H
2↑ 2Al + 2NaOH + 6H
2O → 2Na[Al(OH)
4] + 3H
2↑
 4) Ind (In, łac. indium = indygo) - jest to pierwiastek chemiczny, metal z bloku p układu okresowego. Został odkryty w 1863 r. przez Ferdinanda Reicha i Hieronymousa Theodora Richtera z Akademii Górniczej we Freibergu. Nazwa pochodzi od koloru indygo jego linii spektralnej (451,13 nm). W temperaturze pokojowej jest odporny na działanie powietrza. Dopiero w podwyższonej temperaturze tworzy tlenek. Nie reaguje z kwasami nieutleniającymi. Z kwasem siarkowym i azotowym reaguje na gorąco. Rozpuszcza się w roztworach zasad. W wyższych temperaturach reaguje z chlorowcami, siarką i azotem.
4) Ind (In, łac. indium = indygo) - jest to pierwiastek chemiczny, metal z bloku p układu okresowego. Został odkryty w 1863 r. przez Ferdinanda Reicha i Hieronymousa Theodora Richtera z Akademii Górniczej we Freibergu. Nazwa pochodzi od koloru indygo jego linii spektralnej (451,13 nm). W temperaturze pokojowej jest odporny na działanie powietrza. Dopiero w podwyższonej temperaturze tworzy tlenek. Nie reaguje z kwasami nieutleniającymi. Z kwasem siarkowym i azotowym reaguje na gorąco. Rozpuszcza się w roztworach zasad. W wyższych temperaturach reaguje z chlorowcami, siarką i azotem.
 5) Tal (Ti, łac. thallium) - jest to pierwiastek chemiczny, metal występujący w bloku p układu okresowego. Nazwa pochodzi od greckiego określenia oznaczającego zieloną gałązkę.
5) Tal (Ti, łac. thallium) - jest to pierwiastek chemiczny, metal występujący w bloku p układu okresowego. Nazwa pochodzi od greckiego określenia oznaczającego zieloną gałązkę.
 1) Bor (B, łac. borium) - pierwiastek chemiczny o liczbie atomowej 5, półmetalz bloku p układu okresowego.
1) Bor (B, łac. borium) - pierwiastek chemiczny o liczbie atomowej 5, półmetalz bloku p układu okresowego.Charakterystyka: Bor pod względem chemicznym przypomina krzem i węgiel, gdyż tworzy borowodory – analogi węglowodorów i krzemowodorów. Reakcja boru z gorącym, stężonym kwasem azotowym prowadzi do utworzenia kwasu borowego H3BO3. Bor tworzy kompleksy z alkoholami polihydroksylowymi, reakcja kwasu borowego z mannitolem jest jednym ze sposobów oznaczania zawartości boru w próbce.
Odmiany alotropowe: Bor posiada dwie odmiany alotropowe: bor amorficzny - posiadający kolor brązowy i bor krystaliczny - czarny, bardzo twardy (twardość 9.3 w skali Mohsa, jest słabym przewodnikiem prądu elektrycznego).
Zastosowanie boru: Bor w postaci wolnego pierwiastka stosuje się jako domieszkę do półprzewodników, natomiast związki boru znajdują zastosowanie w postaci lekkich materiałów, nietoksycznych środków owadobójczych i konserwantów oraz odczynników dla syntezy chemicznej. W technice jądrowej stosowany w produkcji szkła ochronnego, liczników borowych i prętów regulacyjnych reaktorów jądrowych (z uwagi na duży przekrój czynny na neutrony, ok. 75 000 fm²).
Odkrycie: Czysty bor wyizolowało w 1808 jednocześnie trzech chemików: Humphry Davy, Joseph Louis Gay-Lussac i Louis Jacques Thénard.
Występowanie boru: Zawartość w górnych warstwach Ziemi wynosi 0,0009%. Ważniejsze minerały boru to: boraks, kernit, kolemanit i aszaryt. Stabilne izotopy to 10B (19%) oraz 11B (81%). W naturze nigdy nie występuje jako wolny pierwiastek, jego głównym źródłem jest boraks. Z punktu widzenia odżywiania, bogatym źródłem boru są świeże warzywa i owoce, a wśród tych ostatnich przede wszystkim orzechy.
Związki boru: Chemia nieorganiczna boru bywa określana jako najbardziej złożona spośród wszystkich pierwiastków. Najczęściej przyjmuje on stopień utlenienia III. W zdecydowanej większości związków jest on trójwiązalny, ma przy tym zdolność do tworzenia związków z wiązaniami wielocentrowymi (jednym z przykładów jest diboran, B2H6, zawierający trójcentrowe-dwuelektronowe wiązania B−H−B). Znana jest bardzo duża liczba jego związków, zwłaszcza borków metali, o bardzo zróżnicowanej stechiometrii, od M5B do MB66 (a nawet >100) , które nie są zgodne ze standardowymi koncepcjami wiązania chemicznego. Przykłady tego typu związków to B4C, FeB, Mn4B, Pd5B2 i wiele innych. Atomy boru w takich związkach mogą być izolowane lub tworzyć rozmaite układy zawierające wiązania B−B: pary, łańcuchy proste, rozgałęzione i podwójne, warstwy i sieci trójwymiarowe. Znanych jest też wiele układów niestechiometrycznych o zmiennym składzie.
Związki boru wykazują zróżnicowaną rozpuszczalność w wodzie. Oksoborany są w większości słabo rozpuszczalne (poza solami potasowców), jednak żaden ze związków boru nie strąca się w sposób ilościowy, co stanowi problem w oczyszczaniu ścieków.
Przykładowe związki boru:
- borowodorek sodu NaBH4
- borowodory, np. diboran B2H6
- borazol (tzw. nieorganiczny benzen) B3N3H6
- trifluorek boru BF3, trichlorek boru BCl3, tribromek boru BBr3
- tlenek boru B2O3, kwas borowy H3BO3
- boran trietylu BEt3
- związki boroorganiczne
Lotne związki boru barwią płomień na kolor zielony.
Związki boroorganiczne – związki chemiczne boru, pochodne borowodoru, zawierające przynajmniej jedno wiązanie bor–węgiel. Przykładami mogą być aminoborany i iminoborany.
Znaczenie biologiczne: Bor, będąc pierwiastkiem śladowym, jest niezbędny dla roślin i zwierząt. U roślin odpowiada za transport związków organicznych w łyku (głównie cukrów), wpływa na prawidłowy wzrost łagiewki pyłkowej (jego brak powoduje zahamowanie jej wzrostu), wpływa na wytworzenie elementów płciowych u roślin. Jest pierwiastkiem, który bardzo trudno przemieszcza się w roślinie. Jego niedobór może powodować zgorzel liści sercowych i suchą zgniliznę korzeni buraka. Bor ma również wpływ na organizm człowieka, przede wszystkim na jego kościec. Przypuszcza się, iż jest niezbędny do prawidłowej gospodarki wapniowej organizmu. Razem z wapniem, magnezem i witaminą D reguluje metabolizm, wzrost, rozwój tkanki kostnej. Jego niedobór powoduje utratę wapnia i demineralizację kości. W większych ilościach związki boru, szczególnie lotne, są trujące.
Związki boru:
-> Borany:
-> Organiczne związki boru -> Związki boroorganiczne:
- hematotoksyczność (małopłytkowość, neutropenia, niedokrwistość)
- utrata apetytu
- zaburzenia neurologiczne (neuropatia obwodowa, obwodowa neuropatia czuciowa, parestezje, bóle głowy)[71]
- duszności
- zaburzenia ze strony układu pokarmowego (wymioty, biegunka, nudności, zaparcia)[72]
- wysypka
- bóle mięśni
- zmęczenie
- gorączka.
Do rzadziej występujących działań niepożądanych zaliczyć można:
- zakażenia górnych dróg oddechowych, zakażenia wirusem opryszczki[73]
- leukopenię, limfopenię
- odwodnienie
- hipokaliemię, hipoglikemię
- stany dezorientacji, depresję, bezsenność, lęk
- polineuropatię, zaburzenia smaku i czucia, niedoczulicę, drżenie
- zaburzenia widzenia
- zawroty głowy
- niedociśnienie ortostatyczne/niedociśnienie związane z pozycją ciała,
- zapalenie żył w miejscu wstrzyknięcia
- krwawienia z nosa, katar
- kaszel, duszność wysiłkową
- zaburzenia dyspeptyczne (wzdęcia, niestrawność, bóle brzucha)
- suchość w ustach
- bóle gardła i krtani
- obrzęki w okolicach oczu
- pokrzywkę, świąd, rumień, wypryski[74]
- zwiększoną potliwość
- złe samopoczucie i objawy grypopodobne
- zmniejszenie masy ciała
- zwiększenie aktywności dehydrogenazy mleczanowej we krwi.
Rzadko mogą wystąpić:
- różne zakażenia wywołane przez bakterie[75], wirusy lub grzyby chorobotwórcze
- zespół rozpadu guza
- pancytopenia, niedokrwistość hemolityczna, plamica małopłytkowa, limfadenopatia
- nadwrażliwość na lek
- zaburzenia w wydzielaniu hormonu antydiuretycznego
- zaburzenia gospodarki mineralnej
- zaburzenia psychiczne
- porażenie poprzeczne
- krwotok wewnątrzczaszkowy
- krwotok podpajęczynówkowy
- drgawki
- zespół niespokojnych nóg
- zaburzenia słuchu
- zaburzenia w pracy serca i układu krążenia
- zaburzenia wątroby i nerek
- zaburzenia erekcji, ból jąder.
Dawkowanie
Dawkowanie w monoterapii
Początkowa dawka bortezomibu powinna wynosić 1,3 mg/m² powierzchni ciała, dwa razy w tygodniu, przez dwa tygodnie (w dniach 1, 4, 8 i 11), a następnie 10-dniowy okres odpoczynku (od 12 do 21 dnia). Opisany trzytygodniowy okres stanowi jeden cykl leczenia. Pomiędzy kolejnymi dawkami bortezomibu powinny upłynąć co najmniej 72 godziny. Zaleca się, by pacjenci, u których uzyskano odpowiedź całkowitą, otrzymali dodatkowe dwa cykle leczenia. Ponadto zaleca się, by pacjenci, którzy na leczenie odpowiedzieli częściowo, otrzymali w sumie 8 cykli. Dawkowanie powinno zostać dostosowane w razie wystąpienia neuropatii związanej z bortezomibem, w zależności od stopnia ciężkości tego działania niepożądanego[77]:
- neuropatia I. stopnia (parestezje, osłabienie i/lub zniesienie odruchów) bez występowania utraty funkcji – nie ma konieczności modyfikacji dawki
- neuropatia I. stopnia z bólem lub II. stopnia (z zaburzeniami funkcji, lecz nie utrudniający codziennej aktywności) – dawkę należy zredukować do 1,0 mg/m² pc.
- neuropatia II. stopnia z bólem lub III. stopnia (z utrudnieniami w codziennej aktywności) – należy przerwać podawanie bortezomibu do momentu ustąpienia objawów toksycznych. Następnie leczenie należy rozpocząć od zredukowanej dawki 0,7 mg/m² pc., podawanej tylko raz w tygodniu
- neuropatia IV. stopnia (neuropatia czuciowa, która utrudnia funkcjonowanie lub neuropatia ruchowa zagrażająca życiu lub prowadząca do porażenia) i/lub ciężka neuropatia autonomicznego układu nerwowego – leczenie bortezomibem należy przerwać
Dawkowanie w leczeniu skojarzonym
Bortezomib podawany jest razem z melfalanem i prednizonem przez dziewięć 6-tygodniowych cykli. W trakcie cykli 1–4 bortezomib podaje się dwa razy w tygodniu (dni: 1, 4, 8, 11, 22, 25, 29 i 32). W trakcie cykli 5–9 lek podaje się raz w tygodniu (dni: 1, 8, 22 i 29). Obowiązuje dawkowanie standardowe, czyli 1,3 mg/m² pc. Przed rozpoczęciem każdego cyklu należy określić liczbę płytek krwi i neutrofili oraz ocenić toksyczność niehematologiczną. Gdy liczba płytek wynosi ≥70·109/l, bezwzględna liczba neutrofili ≥1,0·109/l, a toksyczność niehematologiczna nie przekracza stopnia pierwszego, można wtedy rozpocząć nowy cykl leczenia. Gdy przekracza ona 3. stopień, leczenie bortezomibem należy przerwać, aż do momentu ustąpienia objawów toksycznych. Następnie dawkę należy zmniejszyć o jeden poziom (z 1,3 mg/m² na 1,0 mg/m² lub z 1,0 mg/m² na 0,7 mg/m²). Rozcieńczony roztwór bortezomibu podaje się dożylnie w formie bolusa, trwającego 3–5 sekund, do żył obwodowych lub przez centralny dostęp żylny. Po podaniu leku wkłucie powinno zostać przepłukane 0,9% roztworem chlorku sodu.
Preparaty
- Velcade (Janssen-Cilag) – fiolka zawierająca 1 mg lub 3,5 mg bortezomibu w postaci estru z mannitolem
 2) Glin (w technice: aluminium; Al, łac. aluminium) - jest to pierwiastek chemiczny, metal z bloku p układu okresowego. Jedynym izotopem stabilnym jest 27Al. Glin jest trzecim najpowszechniej występującym pierwiastkiem w skorupie ziemskiej. Od jego symbolu (oraz symbolu krzemu) wywodzi się dawna nazwa najbardziej zewnętrznej warstwy globu – sial.
2) Glin (w technice: aluminium; Al, łac. aluminium) - jest to pierwiastek chemiczny, metal z bloku p układu okresowego. Jedynym izotopem stabilnym jest 27Al. Glin jest trzecim najpowszechniej występującym pierwiastkiem w skorupie ziemskiej. Od jego symbolu (oraz symbolu krzemu) wywodzi się dawna nazwa najbardziej zewnętrznej warstwy globu – sial. |
| Źródło: images-of-elements.com - Glin. |
 |
| Źródło: Wikimedia. Sial i sima. |
Historia: Sole i tlenki glinu znane były od zarania dziejów. Uwodniony, mieszany siarczan tego pierwiastka, ałun, był używany jako środek antyseptyczny przez Starożytnych Greków.
(...) Istnienie tego pierwiastka i nazwę zasugerował Louis - Bernard Guyton de Morveau w 1761 r. W 1807 podobną sugestię wyraził sir Humphry Davy, który zaproponował współczesną nazwę (aluminium).
(...) Istnieją kontrowersje na temat tego, kto pierwszy wyodrębnił ten pierwiastek w stanie czystym. Według jednych źródeł był to Friedrich Wöhler w 1827 r. wg innych Hans Christian Ørsted w 1825 r. Amerykanin Charles Martin Hall i Francuz Paul-Louis Toussaint Héroult w 1886 opracowali produkcję glinu na skalę przemysłową. Niezależnie od siebie opracowali metodę otrzymywania aluminium w procesie elektrolizy stopionej mieszaniny kriolitu i boksytu, obecnie znanym jako proces Halla-Heroulta.
Przeprowadził wiele badań nad właściwościami cieczy i gazów, w których skupiał się najbardziej na ściśliwości owych materii.
Właściwości chemiczne: Glin w stanie czystym szybko utlenia się na powietrzu, ulegając pasywacji. Pierwotnie pokrywa się warstwą Al2O3 o grubości kilku nm. Pod wpływem wilgoci zewnętrzna warstwa tej powłoki ulega częściowej hydrolizie i składa się z Al2O3 i Al(OH)3. Natomiast wewnętrzną warstwę tworzy Al2O3, częściowo uwodniony do Al(O)OH. Stanowi ona ścisłą powłokę chroniącą metal przed dalszą korozją w zwykłych warunkach. Jest ona odporna na działanie roztworów wodnych o pH 4–9.
Łatwo roztwarza się w rozcieńczonych roztworach mocnych kwasów (np. HCl) i zasad (np. NaOH lub KOH) wypierając wodór, np:
3 + 3H
2↑
2O → 2Na[Al(OH)
4] + 3H
2↑
Jego reaktywność wobec kwasu siarkowego opisywana jest różnie:
- wg François Cardarelliego reaguje z rozcieńczonym H
2SO
4 z wydzieleniem wodoru:
- 2Al + 3H
2SO
4 → Al
2(SO
4)
3 + 3H
2↑
- a ze stężonym H
2SO
4 reaguje łatwo z wydzieleniem dwutlenku siarki:
- a ze stężonym H
- 2Al + 6H
2SO
4 → Al
2(SO
4)
3 + 6H
2O + 3SO
2↑
- wg Richarda J. Lewisa, Sr., reaguje jedynie z gorącym stężonym H
2SO
4, natomiast na działanie kwasu rozcieńczonego lub zimnego stężonego jest odporny.
(...) W stężonym kwasie azotowym ulega silnej pasywacji, dzięki czemu , dzięki czemu jest odporny na jego działanie i jest wykorzystywany w przemyśle do wytwarzania zbiorników do jego transportu. Z kolei z chlorowanymi węglowodorami reaguje gwałtownie. Także H2O w wysokiej temperaturze (180 °C) utlenia glin szybko.
W związkach występuje na III stopniu utlenienia, bardzo rzadko również na I i II.
Właściwości fizyczne: Jest srebrzystobiałym metalem o niskiej gęstości, bardzo dobrej kowalności i dużej plastyczności. Jest łatwy w odlewaniu i obróbce, podczas której nie tworzy iskier. Wykazuje dobre przewodnictwo elektryczne, jest paramagnetyczny. W postaci czystej jego właściwości mechaniczne są słabe, które jednak można znacząco poprawić poprzez niewielkie ilości dodatków stopowych. Cienkie powłoki naparowanego glinu są trwałymi, bardzo dobrymi zwierciadłami dla światła widzialnego i promieniowania cieplnego (czysty glin odbija do 99% światła widzialnego do 95% podczerwieni).
Zastosowanie:
Stopy aluminium: Ze względu na swoje właściwości, takie jak mała gęstość i odporność na korozję, stopy glinu z miedzią i magnezem zwane duraluminium znalazły wiele zastosowań i są używane do wyrobu szerokiej grupy produktów – od części karoserii i silników samochodów, przez poszycia i elementy konstrukcyjne samolotów, po części statków kosmicznych. Tak zwane aluminium utwardzane dyspersyjnie jest wykorzystywane w produkcji koszulek elementów paliwowych i konstrukcyjnych rdzeni niektórych badawczych reaktorów jądrowych. Stopów aluminium z manganem i magnezem używa się do produkcji puszek do napojów (stopy 3004 lub 3104 na ścianki oraz 5182 na wieczka).
Czysty glin: Próżniowe napylenie glinu na powierzchnię szkła lub przezroczystych tworzyw sztucznych wykorzystywane jest do produkcji luster.
Pył glinowy: Sproszkowany glin używany jest w hutnictwie do otrzymywania metali z ich tlenków w procesie aluminotermii. Stosowana w tym procesie mieszanina glinu oraz tlenków metali jest znana pod nazwą termit. Termitu używa się do spawania rur i szyn kolejowych, a także do produkcji broni zapalającej. Pył glinowy jest często składnikiem farb metalicznych odpowiedzialnym za charakterystyczny połysk.
(...) W syntezie chemicznej pył aluminium stosowany jest w reakcjach uwodorniania i jako zamiennik cynku w reakcji Reformatskiego.


(...) Pył glinowy stosowany jest również w przemyśle spożywczym, jako barwnik metaliczny. Używany jest przy srebrnych dekoracjach ciast i tortów. Parlament Europejski uznał, że dodawanie aluminium powinno być zakazane, ponieważ istnieją przesłanki, że ma związek z chorobą Alzheimera, choć do tej pory nie udało się tego jednoznacznie udowodnić.
Folia aluminiowa: Folie aluminiowe o różnej grubości stosowane są do pakowania (m.in. żywności) oraz do różnorodnych celów w technikach laboratoryjnych. Folia aluminiowa jest także wykorzystywana jako tzw. lustro lub ekran cieplny (odbijający promieniowanie podczerwone) do zapobiegania utraty ciepła. W tym celu stosuje się albo samą folię aluminiową (np. o grubości 0,05 mm), albo połączoną trwale z materiałem termoizolacyjnym.
Folia aluminiowa: Folie aluminiowe o różnej grubości stosowane są do pakowania (m.in. żywności) oraz do różnorodnych celów w technikach laboratoryjnych. Folia aluminiowa jest także wykorzystywana jako tzw. lustro lub ekran cieplny (odbijający promieniowanie podczerwone) do zapobiegania utraty ciepła. W tym celu stosuje się albo samą folię aluminiową (np. o grubości 0,05 mm), albo połączoną trwale z materiałem termoizolacyjnym.
Związki glinu: Najważniejsze związki glinu to tlenek glinu i amfoteryczny wodorotlenek glinu. Glin tworzy też wodorek, a tetrahydroglinian litu LiAlH4 jest powszechnie stosowanym w chemii organicznej silnym środkiem redukującym. Duże znaczenie przemysłowe mają też aluminoksany, a zwłaszcza MAO (metylowy aluminoksan), z którego produkuje się sita molekularne, oraz powszechnie wykorzystuje jako stałe podłoże dla wielu katalizatorów. Glina i kaolin, powszechnie wykorzystywane przy produkcji ceramiki, to złożone mieszaniny glino-krzemianów.
Wytwarzanie
Aluminium wytwarzane jest z boksytu w następujących po sobie procesach:
- proces Bayera
- proces elektrolizy Halla-Héroulta
 |
| Źródło: metalspace.ru - Carl Josef Bayer. |
Carl Josef Bayer, także Karl Bayer (ur. 4 marca 1847 w Bielsku, zm. 22 października 1904 w Rečicy nad Paką) – austriacki chemik, znany przede jako wynalazca tak zwanego procesu Bayera wykorzystywanego do wytwarzania metalicznego glinu.
Życiorys:
Bayer urodził się w Bielsku (dziś Bielsko-Biała) na Śląsku Austriackim. Początkowo pracował w biurze budowlanym ojca i zamierzał kształcić się w kierunku architektury, z czasem jednak jego zainteresowania przeszły w stronę nauk przyrodniczych. W latach 1864–1865 uczył się przez cztery semestry u Carla Remigiusa Freseniusa w Wiesbaden, a następnie pracował jako chemik w hucie żelaza braci Dorlodot w belgijskim Acoz.
W 1869, w wieku 22 lat, rozpoczął studia chemiczne na Uniwersytecie Ruprechta i Karola w Heidelbergu, gdzie już po dwóch semestrach otrzymał od profesora Roberta Bunsena stanowisko asystenta. W 1871 zdobył stopień doktora. W egzaminach doktorskich, które odbyły się 31 lipca 1871, wzięło udział 26 naukowców, wśród nich Bunsen, Gustav Kirchhoff i Hermann von Helmholtz.
W 1887 dokonał odkrycia, które rozsławiło go w świecie: proces Bayera. Jest to metoda otrzymywania, z rud boksytu, tlenku glinu (Al2O3), stosowanego potem jako substrat w procesie Halla-Héroulta do otrzymywania metalicznego glinu. Mieszkał w tym czasie w Petersburgu i tam złożył pierwsze zgłoszenie patentowe. Wśród innych zagadnień, którymi Bayer się zajmował, były działanie i zastosowania kwasu salicylowego, chemia indu(jego praca doktorska nosiła tytuł Przyczynek do chemii indu) oraz wytwarzanie sztucznego kriolitu.
We wrześniu 1892 poślubił Almę von Witte, bratanicę rosyjskiego premiera Siergieja Wittego, z którą miał szóstkę dzieci: Ericha, Waltera, Guido, Herberta, Fritza i Elsę. W 1896 kupił ziemię w Rečicy nad Paką w Dolnej Styrii, na której zbudował fabrykę aluminium, laboratorium chemiczne i stojącą do dziś rodzinną willę.
Bayer władał siedmioma językami: niemieckim, francuskim, angielskim, rosyjskim, włoskim, polskim i słowackim. Należał do miłośników sztuki i muzyki. Był przekonany o upowszechnieniu się w przyszłości wyrobów aluminiowych na całym świecie.
Zmarł w wieku 57 lat, w październiku 1904. Za swoje osiągnięcia naukowe został uhonorowany Złotym Medalem Francuskiej Akademii Nauk.
* Aeral - stop składający się z aluminium z dodatkiem miedzi, manganu oraz magnezu.
Ma zastosowanie przede wszystkim w przemyśle lotniczym i samochodowym.
*Znal – stop cynku z aluminium lub z aluminium i miedzią. Jako dodatki stosuje się również mangan, magnez i tytan. Charakteryzuje go niestałość wymiarowa będąca wynikiem naturalnego starzenia. Nazwa jest skrótowcem utworzonym od symboli podstawowych składników: Zn (cynku) i Al (aluminium).
Przeznaczony jest do wykonywania precyzyjnych odlewów i do obróbki plastycznej, np. do produkcji gaźników samochodowych i motocyklowych (główne zastosowanie), części do mebli (zawiasy, uchwyty), panewek łożysk ślizgowych, elementów armatury i innych.
ZWIĄZKI GLINU:
--> Glinokrzemiany:
Glinokrzemiany – grupa nieorganicznych związków chemicznych, sole, w których występują aniony złożone z glinu, krzemu i tlenu. Bardzo szeroka klasa materiałównaturalnych i syntetycznych, obejmująca m.in. powszechnie występujące w naturze zeolity, kaolin, andaluzyt, dysten, silimanit i anortyt oraz syntetyczne glinokrzemiany polimeryczne, np. geopolimery.
----> Zeolity:
 3) Gal (Ga, łac. Gallium) - jest to pierwiastek chemiczny z bloku p układu okresowego, o liczbie atomowej 31. Jest twardym i kruchym metalem o kolorze srebrzystobiałym. Ma przełam muszlowy podobny do szkła. Topi się w temperaturze 29,76 °C i trzymany w dłoni zamienia się w ciecz.
3) Gal (Ga, łac. Gallium) - jest to pierwiastek chemiczny z bloku p układu okresowego, o liczbie atomowej 31. Jest twardym i kruchym metalem o kolorze srebrzystobiałym. Ma przełam muszlowy podobny do szkła. Topi się w temperaturze 29,76 °C i trzymany w dłoni zamienia się w ciecz.
--> Nieorganiczne sole glinu:
 3) Gal (Ga, łac. Gallium) - jest to pierwiastek chemiczny z bloku p układu okresowego, o liczbie atomowej 31. Jest twardym i kruchym metalem o kolorze srebrzystobiałym. Ma przełam muszlowy podobny do szkła. Topi się w temperaturze 29,76 °C i trzymany w dłoni zamienia się w ciecz.
3) Gal (Ga, łac. Gallium) - jest to pierwiastek chemiczny z bloku p układu okresowego, o liczbie atomowej 31. Jest twardym i kruchym metalem o kolorze srebrzystobiałym. Ma przełam muszlowy podobny do szkła. Topi się w temperaturze 29,76 °C i trzymany w dłoni zamienia się w ciecz.
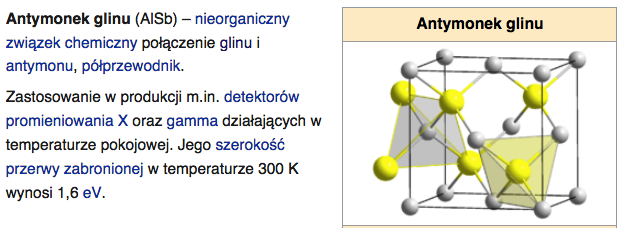
Występuje w śladowych ilościach w boksycie, kaolinicie i rudach cynku. Na skalę przemysłową uzyskuje się go z boksytu. Ciekawą właściwością galu jest jego niska temperatura topnienia i wysoka temperatura wrzenia (2204 °C), dzięki czemu stosuje się go przy produkcji termometrów wysokotemperaturowych. Stop galu z indem i cyną (galinstan) ma jeszcze niższą temperaturę topnienia (około −20 °C). W przeciwieństwie do rtęci, gal i jego związki nie są trujące. Powszechnie wykorzystywanym związkiem galu jest arsenek galu, będący półprzewodnikiem, mającym wiele zastosowań.
Istnieją dwa trwałe izotopy galu o masach atomowych 69 i 71. Znane są także dziesiątki izotopów radioaktywnych, o krótkich czasach połowicznego rozpadu.
Odkrycie: Gal został odkryty w 1875 podczas analizy widmowej błyszczu cynkowego. Francuski chemik Lecoq de Boisbaudran zauważył kilka fioletowych prążków zwiastujących istnienie nieznanego dotąd pierwiastka. W tym samym roku uzyskał wolny gal, poddając elektrolizie amoniakalny roztwór siarczanu galu. Gal wydzielił się na platynowej katodzie.
Pol: Masz za zadanie rozdzielić od siebie składniki amoniakalnego roztworu siarczanu galu i udowodnić, że gal jest pierwiastkiem. W jaki sposób to zrobisz?
(...) Istnienie galu, na podstawie prawa okresowości pierwiastków, przewidzieli Dymitr Mendelejew (1869) i Julius Lothar Meyer (1870). Mendelejew nadał mu nazwę ekaglin i trafnie przewidział jego właściwości. Zgadzała się wartościowość (+3), taka sama jak glinu. Mendelejew uważał, że masa atomowa będzie wynosić 68, a Boisbaudran stwierdził, że jest ona równa 69,865. Mendelejew twierdził, że ekaglin będzie tworzyć ałuny, co też się potwierdziło. Jedynie podany przez Boisbaudrana ciężar właściwy znacznie różnił się od przewidywań Mendelejewa. Mendelejew zwrócił się listownie do odkrywcy, prosząc go, by zechciał jeszcze raz sprawdzić swoje pomiary, bowiem ciężar właściwy galu powinien według niego wynosić około 6 g/cm³. Po sprawdzeniu okazało się, że pomiary Boisbaudrana faktycznie były błędne i ciężar właściwy galu wynosi 5,935 g/cm³. Później, po przeprowadzeniu bardziej precyzyjnych pomiarów, stwierdzono, że wynosi on 5,904 g/cm³.
Właściwości: Pierwiastkowy gal nie występuje w przyrodzie, ale można go łatwo uzyskać poprzez wytapianie. Bardzo czysty gal ma srebrzysty kolor. Należy unikać przechowywania go w pojemnikach ze szkła, ponieważ rozszerza się on podczas krzepnięcia o ok. 3,1%. Podobnie jak rtęć, gal w stanie ciekłym tworzy spontanicznie stopy z wieloma innymi metalami, dlatego nie należy go przechowywać w metalowych pojemnikach, w związku z czym przechowuje się go w pojemnikach polietylenowych.
Niska temperatura topnienia (ok. 29,8 °C) pozwala na roztopienie galu poprzez trzymanie go w dłoni. W stanie ciekłym ma tendencję do przechładzania się, do krystalizacji potrzebny jest zarodek krystalizacji. Gal jest jednym z niewielu metali (obok rubidu, cezu czy rtęci), które są ciekłe w temperaturze zbliżonej do pokojowej, w związku z tym znajduje zastosowanie przy produkcji wysokotemperaturowych termometrów. Gal ma także bardzo wysoką (w porównaniu z jego temperaturą topnienia) temperaturę wrzenia (i bardzo niską prężność pary). W przeciwieństwie do rtęci, ciekły gal zwilża szkło i skórę, w związku z czym praca z nim może być niewygodna, lecz nie jest on trujący.
Zarodek krystalizacji (nazywany dawniej zaródź krystalizacji) – punkt w przestrzeni, od którego zaczyna się proces krystalizacji.
Istnieją dwa rodzaje zarodków krystalizacji:
- Homofazowe (homogeniczne) – przypadkowe ośrodki w krystalizującej cieczy, od których spontanicznie zaczyna się krystalizacja. W teorii krystalizacji homofazowej przyjmuje się, że ośrodki te powstają na skutek lokalnych przypadkowych fluktuacji gęstości cieczy spowodowanych ruchami Browna lub w wyniku wymuszonego mechanicznie przepływu cieczy (np. poprzez mieszanie).
- Heterofazowe (heterogeniczne) – centra krystalizacji na granicy ciecz-ciało stałe lub ciecz-gaz, których struktura ułatwia rozpoczęcie krystalizacji, np. zadrapania na powierzchni naczynia, drobne zanieczyszczenia, czy mikrodziury kawitacyjne. Heterogenicznymi zarodkami krystalizacji mogą też być drobne monokryształykrystalizowanej substancji i zanieczyszczenia znajdujące się w objętości cieczy.
Gal krystalizuje w układzie rombowym o unikatowej strukturze, w której każdy atom ma bliskiego sąsiada w odległości 244 pm i 3 pary dalszych atomów oddalonych o 270–280 pm. Jest to struktura, której nie przyjmuje żaden inny metal, natomiast przypomina strukturę krystaliczną jodu. Wiązania pomiędzy najbliższymi atomami mają charakter kowalencyjny, w związku z czym podstawowymi cząsteczkami budującymi kryształy galu są dimery Ga2.
Gal powoli roztwarza się w mocnych kwasach i zasadach. Fluorek, arsenek i fosforek galu mają własności półprzewodnikowe. Domieszkuje się nimi krzem stosowany w przemyśle elektronicznym. Warstwy z arsenku galu stosuje się w układach scalonych typu MMIC. Gal nie ma żadnego znaczenia biologicznego, ale istnieją przypuszczenia, że ma on wpływ na szybkość przemiany materii. Związki galu nie wykazują działania toksycznego.
Zastosowania:
- jako domieszka przy produkcji półprzewodników i tranzystorów
- do produkcji luster (gdyż zwilża szkło)
- przy produkcji stopów niskotopliwych
- do polepszania właściwości spoiw lutowniczych
- do produkcji termometrów wysokotemperaturowych
- jako katalizator w produkcji wodoru z wody metodą utleniania glinu
- do sztuczek iluzjonistycznych typu zginanie łyżeczek w dłoni
Stop galu, indu i cyny (galinstan) bywa stosowany w termometrach lekarskich – jego temperatura topnienia wynosi około −20 °C.
Związki galu:
 4) Ind (In, łac. indium = indygo) - jest to pierwiastek chemiczny, metal z bloku p układu okresowego. Został odkryty w 1863 r. przez Ferdinanda Reicha i Hieronymousa Theodora Richtera z Akademii Górniczej we Freibergu. Nazwa pochodzi od koloru indygo jego linii spektralnej (451,13 nm). W temperaturze pokojowej jest odporny na działanie powietrza. Dopiero w podwyższonej temperaturze tworzy tlenek. Nie reaguje z kwasami nieutleniającymi. Z kwasem siarkowym i azotowym reaguje na gorąco. Rozpuszcza się w roztworach zasad. W wyższych temperaturach reaguje z chlorowcami, siarką i azotem.
4) Ind (In, łac. indium = indygo) - jest to pierwiastek chemiczny, metal z bloku p układu okresowego. Został odkryty w 1863 r. przez Ferdinanda Reicha i Hieronymousa Theodora Richtera z Akademii Górniczej we Freibergu. Nazwa pochodzi od koloru indygo jego linii spektralnej (451,13 nm). W temperaturze pokojowej jest odporny na działanie powietrza. Dopiero w podwyższonej temperaturze tworzy tlenek. Nie reaguje z kwasami nieutleniającymi. Z kwasem siarkowym i azotowym reaguje na gorąco. Rozpuszcza się w roztworach zasad. W wyższych temperaturach reaguje z chlorowcami, siarką i azotem.
Występowanie i otrzymywanie: Zawartość indu w skorupie ziemskiej średnio wynosi około 50 ppb (µg/kg), a w wodzie 0.1-0.01 ppt (ng/kg). W przyrodzie występuje w minerałach: rokezycie CuInS2, indycieFeIn2S4 i gallindycie In(OH)3. Często towarzyszy rudom cynku, żelaza, miedzi i cyny. Metaliczny ind otrzymuje się przez redukcję tlenku indu wodorem lub metodą elektrolizyroztworu jego soli.
Zastosowania: Ind wykorzystywany jest intensywnie przez przemysł półprzewodnikowy, m.in. do wytwarzania tranzystorów p-n-p z germanem oraz do niskotemperaturowego lutowania półprzewodników. Z pierwiastkami grupy 15 tworzy półprzewodniki III-V. Spośród nich arsenek indu(InAs) i antymonek indu (InSb) są stosowane do produkcji tranzystorów niskotemperaturowych i termistorów, a fosforek indu (InP) do tranzystorów wysokotemperaturowych. Ind stosuje się też jako dodatek stopowy (np. do stali) podwyższających ich twardość i odporność na korozję. Wykorzystuje się go (w postaci drutu) przy produkcji termometrów oporowych i przyrządów optycznych. Wchodzi w skład metalicznych powłok antykorozyjnych. Niektóre stopy indu mają właściwości nadprzewodzące. W postaci tlenku indowo-cynowego jest wykorzystywany w wyświetlaczach ciekłokrystalicznych (LCD). Wytwarza się z niego stopy niskotopliwe (stop zawierający 24% indu i 76% galu). Tlenek indu stosuje się również przy wytwarzaniu powierzchni o własnościach elektroluminescencyjnych. W pierwszej dekadzie XXI w. produkcja indu zaczęła gwałtownie wzrastać z powodu zastosowań tego pierwiastka w przemyśle elektronicznym, szczególnie w produkcji wyświetlaczy LCD oraz paneli słonecznych. W 2007 roku 75% rocznej produkcji indu zużyto do produkcji LCD dla odbiorników telewizyjnych i wyświetlaczy w telefonach komórkowych. Zaledwie 8% odbiorników telewizyjnych na świecie są odbiornikami LCD, co stwarza potencjalnie duży wzrost zapotrzebowania na ten metal. W 2011 globalna produkcja indu wyniosła 1800 ton, z czego Japonia zużyła 60%. Ze względu na duży przekrój czynny dla neutronów ind używany jest także do produkcji prętów kontrolnych do reaktorów jądrowych. Inne zastosowanie to detekcja neutronów metodą aktywacyjną.
 5) Tal (Ti, łac. thallium) - jest to pierwiastek chemiczny, metal występujący w bloku p układu okresowego. Nazwa pochodzi od greckiego określenia oznaczającego zieloną gałązkę.
5) Tal (Ti, łac. thallium) - jest to pierwiastek chemiczny, metal występujący w bloku p układu okresowego. Nazwa pochodzi od greckiego określenia oznaczającego zieloną gałązkę.
Charakterystyka: Jest miękkim, srebrzystym metalem, podobnym z wyglądu do ołowiu, jego powierzchnia szybko matowieje na powietrzu na skutek utleniania. Tal reaguje z rozcieńczonymi mocnymi kwasami nieorganicznymi (z wyjątkiem kwasu solnego), wypierając z nich wodór. W kontakcie z kwasem chlorowodorowym pokrywa się pasywnąwarstwą nierozpuszczalnego chlorku talu(I) (TlCl). Potencjał standardowyTl+/Tl wynosi -0,34. Tal występuje w związkachna I i III stopniu utlenienia. Kationy Tl+są bezbarwne, wodorotlenek talu(I)(TlOH) jest rozpuszczalną w wodzie, mocną zasadą. JonyTl3+ istnieją w roztworze tylko przy pH bliskim 0, w wyższym wytrąca się Tl(OH)3, który nie ma właściwości amfoterycznych.
Toksyczność: Związki talu są silnie toksyczne. Sam tal w formie pyłu jest również silnie toksyczny, gdyż utlenia się w kontakcie z powietrzem. Do zatruć może dojść drogą pokarmową lub oddechową. Charakterystyczny objaw zatrucia to łysienie poprzedzone czernieniem mieszków włosowych. Ponadto zaburzenia trawienia, bóle neuralgiczne, zmiany psychiczne, uszkodzenia układu sercowo-naczyniowego. Dawniej sole talu były częstym składnikiem trucizn przeciw gryzoniom. Ofiary zatrucia talem występują w powieści Agathy Christie Tajemnica bladego konia. Antidotum dla zatruć związkami talu(III) jest błękit pruski, który tworzy trwałe, nieprzyswajalne związki kompleksowe z tym pierwiastkiem.
Występowanie
Tal występuje w skorupie ziemskiej w ilości 0,6 ppm.
Najważniejszymi minerałamitalu są:
- lorandyt TlAsS2;
- huthinsonit (Pb,Tl)2As5S9.
Tal jest również częstą domieszką w rudach cynku.
Odkrycie: Zostął odkryty w 1861 r. przez sir Williama Crookesa.









































































































































































































































































































Brak komentarzy:
Prześlij komentarz