Zapylenie - to proces, który dokonuje się w kwiatach roślin nasiennych, polegający na przeniesieniu pyłku i jego rozwoju zakończonym zapłodnieniem komórki jajowej. W przypadku nagonasiennych pyłek przenoszony jest bezpośrednio na zalążek, u okrytonasiennych - na znamię słupka. Zapłodnienie poprzedzone jest rozluźnieniem kontaktu między komórkami tkanki stygmatoidalnej budującej znamię kwiatu oraz rozwojem pyłku, z którego wyrasta łagiewka pyłkowa przenosząca komórki plemnikowe do woreczka zalążkowego.
Rodzaje zapylenia:
- samozapylenie (autogamia) - gdy pyłek kwiatowy pochodzi z tego samego kwiatu, lub innego kwiatu, ale tej samej rośliny.
- zapylenie krzyżowe (ksenogamia, allogamia) - gdy pyłek pochodzi z kwiatu innej rośliny (tego samego gatunku).
Samozapylenie utrudnia powstanie u potomstwa nowych kombinacji genów, z tego właśnie powodu u większości roślin dominują mechanizmy zapobiegające samozapyleniu i ułatwiające zapylenie krzyżowe. Zapylanie pyłkiem pochodzącym od innej rośliny nazywa się obcopylnością, a rośliny te roślinami obcopylnymi. Istnieje wiele sposobów, w jaki pyłek może być przeniesiony z pręcika na znamię słupka i w zależności od tego wyróżnia się wśród roślin obcopylnych następujące rodzaje zapylenia: anemogamia (wiatropylność); hydrogamia (zapylenie przez wodę); zoogamia (zapylenie przez zwierzęta, w tym m.in. owadopylność (entomogamia), ornitogamia lub malakogamia. Najczęściej występującym rodzajem zapylania jest owadopylność, bardzo dużą rolę odgrywa także wiatropylność.
BIOCHEMIA ZAPYLANIA - jest to interdyscyplinarna dziedzina nauk biologicznych, dotycząca biochemicznych mechanizmów rozmnażania się roślin nasiennych (kwiatowych) z udziałem zapylaczy (głównie owadów), leżąca na pograniczu botaniki, zoologii, chemii i ekologii. Analizując międzygatunkowe oddziaływania (często są to działania natury mutualistycznej) między zapylaczami i roślinami bierze się pod uwagę takie czynniki biochemiczne, jak zapach kwiatów i ich barwa, a także smak i wartość energetyczna nektaru i pyłku. Efektywność takiej obustronnie korzystnej interakcji między rośliną i zapylaczem zależy również od wrażliwości zmysłów zapylacza - węchu i wzroku - oraz od cech morfologicznych obu partnerów (np. wielkość i kształt kwiatu, wielkość i budowa aparatu gębowego owada lub innego zapylacza). Istotny jest również wpływ zmiennych w przestrzeni i czasie czynników ekologicznych - abiotycznych i biotycznych - które mogą powodować m.in. niekorzystne zmiany liczebności obu współistniejących populacji.
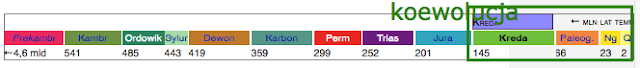
ELEMENTY HISTORII KWIATÓW I OWADÓW: Powszechnie uznaje się, że pierwsze interakcje między roślinami kwiatowymi i owadami - niezwykle efektywny mechanizm reprodukcyjny, który przyspieszył tempo specjacji obu grup gatunków - pojawił się w okresie kredy (145-66 mln lat temu). Nastąpiło to po wielu wcześniejszych etapach rozwoju życia na Ziei, poczynając od prekambru (4567,17-541 mln lat temu).
Z prekambru pochodzą ślady życia archeanów, bakterii, sinic (stromatolity) oraz pierwszych eukariontów. Prawdopodobnie ok. 700 mln lat temu pojawiły się pierwsze organizmy wielokomórkowe, a ok. 650 mln lat temu, m.in. fauna ediakarańska, jamochłony, wiciowce, zielenice.
 |
| Źródło: Slideplayer.com - Fauna ediakarańska. |
 |
| Źródło: qph.ec.quoracdn.net |
 |
| Źródło: basfeijen.nl. Eksplozja kambryjska. |
W kambrze (541-485,4 mln lat temu) - okresie kambryjskiej eksplozji fauny - florę reprezentowały grzyby, glony i porosty. W ordowiku (485,4-443,4 mln lat temu) pojawiły się prawdopodobnie pierwsze grzyby i rośliny lądowe (psylofity, rośliny telomowe, ryniofity, kuksonia), a w sylurze (443,4-419,2 mln lat temu) na nieprzyjaznych dla roślin lądach, tylko gdzieniegdzie pokrytych cienką warstwą gleby, pojawiły się rośliny naczyniowe, początkowe związane z gruntem chwytnikami, a później korzeniami, wytwarzające drewno, łyko, liście. Zasiedlanie odległych od bagnistych wybrzeży części lądów stało się możliwe dzięki roślinom, które zaczęły wytwarzać osłonięte zarodniki, przenoszone przez wiatr (anemochoria).
 |
| Źródło: Wikipedia. Stenophlebia rolfhuggeri - późna jura. |
Skamieniałości zawierające ślady życia pierwszych owadów nie umożliwiają jednoznaczego określenia przebiegu ich ewolucji, jednak przypuszcza się, że pojawiły się w sylurze (najstarsza skamieniałość nie budząca wątpliwości pochodzi sprzed ok. 396 mln lat, z osadów dewońskich). Wówczas zaczęło się rozwijać oddziaływanie roślin nasiennych z owadami, związane z wzajemnymi dostosowaniami drogą doboru naturalnego - darwinowskim "fitness", zwiększającym ewolucyjny sukces obu grup gatunków. Ślady owych zjawisk, zachowane w postaci skamieniałości nie dostarczają informacji o ich biochemicznych mechanizmach, np.
- o barwach kwiatów (barwniki roślinne) i cechach wzroku ówczesnych zapylaczy (w tym budowa fotoreceptorów i preferencje barw),
- o stereochemicznych cechach stosowanych przez rośliny atraktantów - bodźców chemicznych, dostosowanych do możliwości percepcji zapachu i smaku oraz przedstawicieli wabionych zapylaczy (np. skład chemiczny i zapach olejków eterycznych, skład chemiczny i smak nektaru kwiatów).
ZAPYLACZE WE WSPÓŁCZESNYCH EKOSYSTEMACH: Współczesne interakcje między roślinami kwiatowymi i zapylaczami ukształtowały się w epoce holocenu. Są jednym z mechanizmów działania ekosystemów, które decydują o ich dzisiejszej strukturze. Procesy zachodzące w tych systemach są przedmiotem badań zoologów, botaników, ekologów, biochemików, którzy opisują poszczególne elementy biosfery, obserwując je z różnych punktów widzenia i stosując nieustannie doskonalone specjalistyczne techniki badawcze. Rodzaje istniejących współcześnie interakcji między roślinami i zwierzętami są zależne od stref klimatycznych, w których znajdują swoje nisze różne gatunku. W strefie klimatów umiarkowanych powszechnie występującymi zapylaczami są owady (owadopylność), aktywne głównie w ciągu dnia. Są to przede wszystkim trzmiele i pszczoły miodne, lecz również np. małe muchówki lub pchełki. W krajach strefy tropikalnej funkcję zapylaczy pełni wiele dużych tropikalnych motyli i chrząszczy, kolibry (ortogamia), drobne gryzonie, ślimaki (malakogamia). Niektóre z owadów odwiedzających kwiaty i korzystających z nektaru i pyłku nie uczestniczą w zapylaniu. Ich szczególnie wymownym przykładem są mrówki, nie wchodzące w symbiozę z roślinami. Wzajemnie korzystne trwałe interakcje utrudnia fakt, iż wydzielina mrówek zawiera związki bakteriobójcze i grzybobójcze, które są szkodliwe dla pyłku. W Australii zaobserwowano dwa wyjątki od tej zasady. Istnieje bowiem gatunek mrówek, którego osobniki nie wytwarzają antybiotyków. Jest też kilka gatunków storczyków, które są zapylane przez mrówki w czasie ich lotów godowych, ponieważ w tym czasie wytwarzają związki neutralizujące ich wydzielinę.
Wykazano, że kwiaty zapylane przez zwierzęta (zoogamia) charakteryzuje niezmienność cech ustalonych w wyniku koewolucji z zapylaczem. Stałość morfologicznych cech kwiatów, ich barwy i zapachu sprzyja "wierności partnerów" interakcji. W wielu przypadkach rośliny mogą być zapylane przez np. owady bardzo nielicznych gatunków albo nawet przez osobniki tylko jednego gatunku. Z drugiej strony część owadów jest dostosowana do korzystania z nektaru i pyłku kwiatów, które należą do nielicznych gatunków roślin (lub tylko jednego gatunku). Przykłady wybitnego wzajemnego uzależnienia dwóch gatunków zaobserwowano w przypadku figowców o kwiatach zapylanych przez osowate - prawie każdy gatunek rośliny ma "własnego zapylacza". Podobnie ścisłe uzależnienia występują wśród storczykowatych.
 |
| Źródło: Wikipedia. |
ELEMENTY EKOLOGII BIOCHEMICZNEJ ZAPYLANIA: Wzrok zwierząt umożliwia im odbieranie od roślin bodźców - sygnałów dotyczących barwy i kształtu kwiatów. Barwa kwiatów jest ważną informacją przekazywaną zapylaczom w formie światła widzialnego dla człowieka (promieniowania elektromagnetycznego o długościach fal ok. 380-780 nm, na które reagują czopki siatkówki oka) lub w zakresie ultrafioletu (na promieniowanie o tych długościach fali reaguje wzrok części zwierząt). Promieniowanie docierające do oka obserwatora jest tą częścią promieniowania słonecznego (dziennego światła białego), która nie zostałą zaabsorbowana przez obserwowany obiekt, np. płatki kwiatów (została od nich odbita). Różnica między widmem promieniowania padającego i odbitego od płatka kwiatu zależy od zawartości w nim związków chemicznych, które absorbują promieniowanie (barwniki). Obserwator dostrzega barwę, jeżeli energia kwantów absorbowanej części promieniowania odpowiada zakresowi wrażliwości receptorów narządu wzroku.
Związkami odpowiedzialnymi za barwę kwiatów są przede wszystkim flawonoidy - liczna grupa związków obecnych w chromoplastach lub wakuolach, odpowiedzialnych za barwę pomarańczową, czerwoną, niebieską, żółtą i białą. Poza flawonoidami pewną rolę odgrywają karotenoidy (żółte, odcienie czerwone i pomarańczowe). Stosunkowo niewielkie znaczenie mają inne rodzaje barwników naturalnych oraz zielone chlorofile.
Najbardziej powszechne są flawonoidy nazywane antocyjanidynami. Poszczególne związki nie występują in vivo w postaci wolnej, lecz np. metylowanej lub glikozydowej - z resztami cukrowymi przyłączonymi np. w różnych pozycjach podstawowej struktury flawonoidów. Wskutek podstawienia zmienia się widmo absorpcyjne związku (przesuwa się pasmo absorpcji). Podobne efekty wywołuje powstawanie kopigmentów - kompleksów wewnątrz- lub międzycząsteczkowych i inne oddziaływania (np. powstawanie kompleksów z udziałem jonów metali).
 |
| Źródło: Wikipedia. Charakterystyczne cechy cząsteczek będących barwnikami roślinnymi. |
Trzy najbardziej powszechne flawonoidy, antocyjanidyny, są pochodnymi, w których:
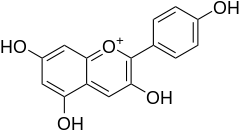 a) Pelargonidyna - jest to organiczny związek chemiczny z grupy antocyjanidynów, występuje on naturalnie jako barwnik roślinny, między innymi w pelargoniach, malinach, truskawkach, owocach śliw, żurawiny a także płatkach róż. Duże jej ilości zawiera czerwona fasola. Jak wszystkie antocyjanidyny jest antyutleniaczem. Pelargonidyna stosowana jest jako barwnik spożywczy. Alkoholowy roztwór pelargonidyny jest wskaźnikiem pH.
a) Pelargonidyna - jest to organiczny związek chemiczny z grupy antocyjanidynów, występuje on naturalnie jako barwnik roślinny, między innymi w pelargoniach, malinach, truskawkach, owocach śliw, żurawiny a także płatkach róż. Duże jej ilości zawiera czerwona fasola. Jak wszystkie antocyjanidyny jest antyutleniaczem. Pelargonidyna stosowana jest jako barwnik spożywczy. Alkoholowy roztwór pelargonidyny jest wskaźnikiem pH.  |
| Źródło: roses.webhost.pl |
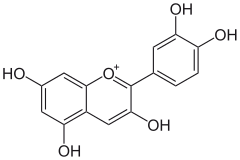 b) Cyjanidyna - jest to organiczny związek chemiczny z grupy antocyjanidynów. Występuje naturalnie jako barwnik roślinny, między innymi w czerwonych owocach roślin takich jak głóg, bez, euterpa, jagodach czy kwiecie hibiskusa. Może być znaleziona także w jabłkach, śliwkach, czerwonej kapuście i czerwonej cebuli. Największe jej stężenie występuje w skórce. Ma charakterystyczną pomarańczowo-czerwoną barwę, która może zmieniać się wraz z pH: roztwory o pH < 3 przybierają barwę czerwoną, fioletową przy pH = 7-8, a niebieską przy pH > 11. Stosowana jako czerwony barwnik do żywności. Cyjanidyna i jej glikozydy mają właściwości prozdrowotne: przeciwnowotworowe, ochronne dla naczyń krwionośnych, przeciwzapalne, zapobiegające otyłości i cukrzycy. Związki te są bardzo silnymi przeciwutleniaczami, silniejszymi niż witamina E, witamina C czy resweratrol. Cyjanidyna szybko neutralizuje reaktywne formy tlenu, takie jak nadtlenek wodoru, rodniki tlenowe i hydroksylowe.
b) Cyjanidyna - jest to organiczny związek chemiczny z grupy antocyjanidynów. Występuje naturalnie jako barwnik roślinny, między innymi w czerwonych owocach roślin takich jak głóg, bez, euterpa, jagodach czy kwiecie hibiskusa. Może być znaleziona także w jabłkach, śliwkach, czerwonej kapuście i czerwonej cebuli. Największe jej stężenie występuje w skórce. Ma charakterystyczną pomarańczowo-czerwoną barwę, która może zmieniać się wraz z pH: roztwory o pH < 3 przybierają barwę czerwoną, fioletową przy pH = 7-8, a niebieską przy pH > 11. Stosowana jako czerwony barwnik do żywności. Cyjanidyna i jej glikozydy mają właściwości prozdrowotne: przeciwnowotworowe, ochronne dla naczyń krwionośnych, przeciwzapalne, zapobiegające otyłości i cukrzycy. Związki te są bardzo silnymi przeciwutleniaczami, silniejszymi niż witamina E, witamina C czy resweratrol. Cyjanidyna szybko neutralizuje reaktywne formy tlenu, takie jak nadtlenek wodoru, rodniki tlenowe i hydroksylowe.  |
| Źródło: bioflawonoidy.pl - Cyjanidyna występuje m.in. w owocach jeżyny w postaci 3-rutynozydo cyjanidyny. |
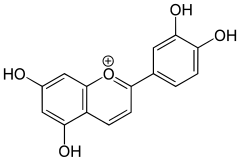
 c) Delfinidyna - jest to organiczny związek chemiczny z grupy antocyjanidynów; występuje naturalnie jako barwnik roślinny, między innymi w owocach (np. winogrona, czarne jagody, czarny bez, żurawina) i płatkach kwiatów (np. bratek, kosaciec i malwa), nadając im niebieski kolor. Od kilkunastu lat z pewnymi sukcesami podejmowane są w Japonii i Australii próby wprowadzenia do genomu róży genu kodującego wytwarzanie delfinidyny, czego efektem mają być róże o niebieskich płatkach. Jednak ze względu na nietrwałość barwnika w kwaśnym środowisku płatków oraz łatwe maskowanie koloru niebieskiego przez inne barwniki, prace nie zostały jeszcze zakończone pełnym sukcesem.
c) Delfinidyna - jest to organiczny związek chemiczny z grupy antocyjanidynów; występuje naturalnie jako barwnik roślinny, między innymi w owocach (np. winogrona, czarne jagody, czarny bez, żurawina) i płatkach kwiatów (np. bratek, kosaciec i malwa), nadając im niebieski kolor. Od kilkunastu lat z pewnymi sukcesami podejmowane są w Japonii i Australii próby wprowadzenia do genomu róży genu kodującego wytwarzanie delfinidyny, czego efektem mają być róże o niebieskich płatkach. Jednak ze względu na nietrwałość barwnika w kwaśnym środowisku płatków oraz łatwe maskowanie koloru niebieskiego przez inne barwniki, prace nie zostały jeszcze zakończone pełnym sukcesem.  |
| Źródło: Wikipedia. Kosacies (Irys) zawiera Delfinidynę w swym kwiecie. |
 |
| Źródło: odzywianie.info.pl - Fiołek trójbarwny zawiera Delfinidynę w swym kwiecie. |
*Antocyjanidyny - jest to grupa organicznych związków chemicznych, bezcukrowych odpowiedników antocyjanów opierających się na jonie flawyliowym lub 2-fenylobenzopiranowym, które są jonami oksoniowymi (najprostszym przykładem tych jonów jest jon hydroniowy). Antocyjanidyny tworzą dużą grupę barwników polimetynowych. Przeciwjonem kationu 2-fenylobenzopiranowego jest najczęściej anion chlorkowy. Dodatni ładunek w cząsteczce antocyjanidynów jest cechą odróżniającą je od innych flawonoidów. Antocyjanidyny różnią się od siebie ilością i położeniem grup hydroksylowych. Ilość grup ma decydujący wpływ na barwę, którą nadaje dany związek. Ogólnie mówiąc obecność pelargonidyny jest odpowiedzialna za barwę różową, szkarłatną i pomarańczową, cyjanidyna za karmazynową, a delfinidyna za fiołkową i niebieską.
ZALEŻNOŚĆ OD PH: Stabilność antocyjanidynów jest zależna od pH. Przy niskich wartościach pH (odczyn kwasowy) w roztworze są obecne barwne antocyjanidyny, a natomiast przy wyższych wartościach pH (odczyn zasadowy) obecne są bezbarwne formy chalkonowe. 3-dezoksyantocyjanidyny są klasą antocyjanidynów, w których brakuje grupy hydroksylowej na trzecim atomie węgla.
 d) Aurantynidyna - jest to organiczny związek chemiczny z grupy antocyjanidynów, będących barwnikami roślinnymi. Jest to hydroksylowa pochodna pelargonidyny. Jest barwnikiem pomarańczowym lub pomarańczowo-brązowym. Aurantynidyna występuje w płatkach rośliny Impatients aurantiaca (niecierpkowate) oraz w odmianach roślin z rodzaju alstremeria.
d) Aurantynidyna - jest to organiczny związek chemiczny z grupy antocyjanidynów, będących barwnikami roślinnymi. Jest to hydroksylowa pochodna pelargonidyny. Jest barwnikiem pomarańczowym lub pomarańczowo-brązowym. Aurantynidyna występuje w płatkach rośliny Impatients aurantiaca (niecierpkowate) oraz w odmianach roślin z rodzaju alstremeria.  |
| Źródło: Wikipedia. Alstemeria pomarańczowa - jej kwiaty posiadają barwnik Aurantynidynę. |
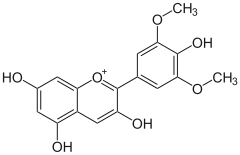
e) Europinidyna (Eu) - jest to organiczny związek chemiczny z grupy O-metylowanych antocyjanidynów, nadający roślinom niebieskawo-czerwoną barwę. Jest rzadkim O-metylowanym flawonoidem, będącym pochodną delfinidyny. Można go znaleźć w gatunkach Plumbago europaea i rodzaju Ceratostigma.
 |
| Źródło: maltawildplants.com - Kwiaty Plumbago europaea zawierają Europinidynę. |
 f) Luteolinidyna - jest to organiczny związek chemiczny z grupy 3-dezoksyantocyjanidyn będących żółtymi barwnikami. W naturze związek ten występuje m.in. w sorgu dwubarwnym.
f) Luteolinidyna - jest to organiczny związek chemiczny z grupy 3-dezoksyantocyjanidyn będących żółtymi barwnikami. W naturze związek ten występuje m.in. w sorgu dwubarwnym.  |
| Źródło: Wikipedia. Sorgo dwubarwne/ Sorgo cukrowe posiada barwnik Luteolinidynę. Roślina ta rośnie dziki w całej niemalże Afryce. |
 g) Malwidyna (Mv) - jest to organiczny związek chemiczny z grupy antocyjanidynów; występuje naturalnie jako barwnik roślinny. Glikozydy malwidyny są bardzo rozpowszechnione w naturze. Jest, między innymi, odpowiedzialna za czerwony kolor wina, a jej źródłem jest winorośl właściwa. Malwidyna i jej glikozydy odpowiedzialne są także za barwę, od czerwonej do niebieskiej, wielu owoców i kwiatów, m.in. winogron, żurawiny, borówek i pierwiosnków. Stosowana jest jako fioletowy barwnik do żywności o numerze E163c. W roztworach wodnych glikozydy malwidyny przy wartościach pH poniżej 4 przybierała czerwone zabarwienie, między 4 a 5 - jasno granatowo-fioletowe, przy 6 do 7 - fioletowe, pomiędzy 7 a 8 - granatowe, a powyżej 8 mają kolor żółty.
g) Malwidyna (Mv) - jest to organiczny związek chemiczny z grupy antocyjanidynów; występuje naturalnie jako barwnik roślinny. Glikozydy malwidyny są bardzo rozpowszechnione w naturze. Jest, między innymi, odpowiedzialna za czerwony kolor wina, a jej źródłem jest winorośl właściwa. Malwidyna i jej glikozydy odpowiedzialne są także za barwę, od czerwonej do niebieskiej, wielu owoców i kwiatów, m.in. winogron, żurawiny, borówek i pierwiosnków. Stosowana jest jako fioletowy barwnik do żywności o numerze E163c. W roztworach wodnych glikozydy malwidyny przy wartościach pH poniżej 4 przybierała czerwone zabarwienie, między 4 a 5 - jasno granatowo-fioletowe, przy 6 do 7 - fioletowe, pomiędzy 7 a 8 - granatowe, a powyżej 8 mają kolor żółty.  |
| Źródło: zielonyogrodek.pl - Winorośl właściwa (Vitis vinifera). Jej owoce zawierają oeninę (glukozyd Malwidyny). |
- Oenina - jest to organiczny związek chemiczny z grupy antocyjanów, będących barwnikami roślinnymi. Oenina jest 3-O-glukozydem malwidyny. Oenina jest głównym barwnikiem w owocach Vitis vinifera i odpowiada za czerwony kolor młodych czerwonych win otrzymywanych z tych winogron.
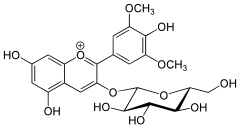 |
Źródło: Wikipedia. Oenina.

Źródło: Wikipedia. Prymulina.

Źródło: houseplantsguru.com - Pierwiosnek chiński (Primula praetinens) posiada w kwiatach barwnik - Prymulinę.
W procesie ewolucji rola poszczególnych barwników roślinnych w środowisku ulegała zmianom. Uważa się, że barwnikiem najbardziej biosyntetycznie prymitywnym jest cyjanidyna (występująca u roślin nagonasiennych, wiatropylnych przodków roślin okrytozalążkowych), a pelargonidyna i delfinidyna są bardziej zaawansowane. Tego typu wnioski są wyciągane na podstawie badań częstości występowania Cy, Pd, i Dp w roślinach różnych stref klimatycznych. Pelargonidyna występuje przede wszystkim w roślinach tropikalnych, 3-dezoksyantocyjanidyny (np. luteolinidyna) - wyłącznie w gatunkach tropikalnych (np. ostrojowate i i bignoniowate).
Badania z dziedziny biochemii zapylania obejmują określanie udziałów Cy, Pd i Dp w różnych zbiorowiskach roślinnych. Stwierdzono np. że udziały wynoszę we florze: Australii - 47% Cy, 2% Pd, 63% Dp; Indii Zachodnich: 70% Cy, 17% Pd, 47% Dp. Różnica między tymi zbiorowiskami jest wyjaśniana różnym udziałem ptaków i owadów, preferujących różne barwy w procesie zapylania (mała rola Pd w Australii jest wiązana z niewielką liczbą zapylających ptaków).
Źródło: Wikipedia.
Ewolucyjne zmiany barw kwiatów w zbiorowiskach roślinnych następują stosunkowo szybko. Stwierdzono, że niekiedy rośliny zmieniają barwę kwiatów w ciągu jednego lub dwóch pokoleń, adaptując się do zmiany udziałów zapylaczy preferujących różne barwy. Kwiaty Ipomopsis aggregata rosnące w Arizonie w pobliżu Flaggstaff zmieniają barwę nawet w czasie jednego sezonu wegetacyjnego. Ich barwa zmienia się z czerwonej na białą poprzez różne odcienie różowej (Stopniowe wyłączanie syntezy antocyjanin w płatkach). Termin tej zmiany jest skorelowany z datą odlotu na południe zapylających kwiaty kolibrów, których funkcje przejmują wówczas zawisaki Hyles lineata. Zmiana barwy kwiatów bywa również wykorzystywana jako sygnał kierujący zapylacze przede wszystkim do kwiatów jeszcze niezapylonych. W kwiatach Lantana camara (lantana pospolita) po zabraniu przez owada nektaru z żółtego kwiatu (barwnik: karotenoidy) następuje zmiana barwy na czerwoną (barwnik: antocyjanina). Dzięki takiemu współdziałaniu dochodzi do szybszego zapylenia wszystkich kwiatów (korzyść rośliny), a owady szybciej odnajdują kwiaty jeszcze zawierające nektar. Analogiczne dostosowania zaobserwowano w latach 1987 - 1991 w co najmniej 74 rodzinach roślin okrytozalążkowych (biochemiczny mechanizm zmian do roku 1997 nie został rozpoznany).

Źródło: Wikipedia. Kwiat poziomki, Fragaria vesca L. - zdjęcia odpowiednio od góry wykonane w świetle widzialnym, ultrafiolecie i podczerwieni.
W wielu kwiatach funkcja barwników nie ogranicza się do wabienia zapylaczy z dalszych
odległości. Liczne barwne wzory odgrywają również rolę "znaków drogowych", wskazujących owadom (najbardziej wyraźnie - pszczołom) miejsca lokalizacji organów płciowych i nektaru. Znaki przybierają formę plam o większej intensywności barwy tego samego barwnika (np. cyjanidyny w dzwonkach naparstnicy pupurowej) albo wyraźniejszych pasków lub plamek (np. brodawki barwnikowe o innym odcieniu). Niektóre z kwiatów zawierają wskaźniki nektaru niewidoczne dla oka ludzkiego. Żółte płatki "Czarnookiej Zuzanny" (Rudbekia hirta) wabiące owady z dużej odległości, zawierają dodatkowo inny żółty barwnik (z grupy flawonoidów), który absorbuje również UV. Jest on skoncentrowany wokół lokalizacji nektaru i wskazuje to miejsce pszczołom, widzącym w tym zakresie długości fal. Analogiczne wskaźniki nektaru, niewidzialne dla człowieka występują również w kwiatach białych.

Źródło: Wikipedia. Fiołek alpejski. Wzór wskazuje drogę do nektaru.

Źródło: Wikipedia. Kwiatostan rudbekii błyskotliwej. Brzeżne kwiaty są języczkowe. W środku koszyczka występują kwiaty rurkowate w kolorze niemalże czarnym.
Koncentracja uwagi na zagadnieniach percepcji barwy sprawia, że pomijany bywa aspekt dotyczący rozpoznawania kształtu kwiatów. Przykładem roli tej funkcji wzroku są interakcje między niektórymi gatunkami storczykowatych a zapylającymi je pszczolinkami. Badania dotyczyły m.in. zachowań dzikich pszczolinek (Andrena), które zapylają nie wytwarzające nektaru storczyki z rodzaju dwulistnik (Ophrys). W zapylaniu uczestniczą wyłącznie samce pszczolinek, wykonujące na kwiatach tzw. "pseudokopulację". Ewolucyjne dostosowanie rośliny do interakcji z owadami polegało na upodobnieniu wyglądu kwiatów (barwa i kształt) do wyglądu samic. Stwierdzono także, że olejki eteryczne dwulistników zawierają składniki stereochemicznie odpowiadające feromonom, wyodrębnionym z gruczołów płciowych samic pszczolinek (roślina wabi owady wyglądem oraz zapachem).
WĘCH, ZAPACH KWIATÓW I FEROMONY OWADÓW: Odpowiedzi na pytania o biochemiczne podstawy działania zmysłu węchu poszukiwano od stuleci, jednak znaczący postęp w tej dziedzinie zanotowano dopiero w końcu XX w. (badania Lindy B. Buck i Richarda Axela - laureatów Nagrody Nobla w dziedzinie fizjologii lub medycyny w roku 2004). Stwierdzono, że wykrywanie cząsteczek odorantów zachodzi z udziałem receptorów węchowych (OR od ang. Olfactory Receptor), należących do rodziny rodopsynopodobnych receptorów klasy A sprzężonych z białkami G, które znajdują się w błonie komórkowej neuronów receptorowych węchu. Pobudzenie tych neuronów jest pierwszym etapem przewodzenia sygnału nerwowego do wyższych pięter układu nerwowego (np. do mózgu człowieka).
Neurony z receptorami OR znajdują się np. wśród komórek nabłonka węchowego nosa, w różnej liczbie u różnych gatunków zwierząt (różnica dotyczy zarówno liczby rodzajów OR, jak ogólnej liczby neuronów nabłonka). U owadów receptory OR są zlokalizowane w ich czułkach - "antenach" wyspecjalizowanych w odbieraniu określonych zapachów, np. feromonów. Wiedza o mechanizmach rozpoznawania zapachu mieszanin odorantów jest dotychczas niepełna.
Również chemiczny skład mieszanin substancji zapachowych, wytwarzanych w kwiatach różnych roślin, nie został ostatecznie poznany. W skład olejków eterycznych wchodzą liczne związki chemiczne - związki aromatyczne i alifatyczne, monoterpeny, seskwiterpeny (m.in. anetol, azuleny, borneol, cytral, egzaltolid, eugenol, farnezol, geraniol, indol, jasmon, kamfen, karwon, linalol, mentol, menton, nerol, alfa-pinen, salicylan metylu, tymol i wiele innych.
1) Anetol, p-metoksypropenylobenzen - jest to organiczny związek chemiczny zbudowany z reszty anizolu podstawionego w pozycji para grupą propylenową; zawiera szkielet styrenu (Ph-CH-CH2). Występuje naturalnie w niektórych roślinach, otrzymywany z olejków eterycznych anyżu i kopru. Stosowany jest jako związek zapachowy w przemyśle spożywczym, kosmetycznym i farmaceutycznym. Może być półproduktem do wytwarzania parametoksyamfetaminy. W związku z hydrofobowym jego charakterem, zawartość anetolu w wódkach i likierach anyżowych (takich jak turecka raki lub grecka ouzo) odpowiada za zmętnienie i mlecznobiałą barwę trunku podczas rozcieńczania wodą - tzw. efekt ouzo.

2) Azuleny - należą one do naturalnych substancji chemicznych z grupy nienasyconych węglowodorów dwupierścieniowych, których pochodne znajdują się w olejkach eterycznych. Od strony chemicznej są to substancje krystaliczne ciemnoniebieskiej barwy. Azulen jest izomerem naftalenu. Posiada skondensowane pierścienie pięico- i siedmioczłonowy. Wchodzi w reakcje podstawienia aromatycznego. Ulega reakcji polimeryzacji co wskazuje na jego nienasycony charakter. Ma charakter zasadowy. Rozpuszcza się w kwasach mineralnych (nieorganicznych). Najbardziej znanymi azulenami są Chamazulen (C14H8) - występujący w olejkach eterycznych rumianku, krwawnika, piołunu. Związek ten charakteryzuje się zdolnością do hamowania syntezy histaminy z komórki tkanki, dzięki czemu jest środkiem o działaniu antyalergicznym bakteriobójczym i przeciwzapalnym. Jako główny składnik olejku krwawnika nadaje temu olejkowi intensywnie niebieską barwę. Inny azulen - Gwajazulen - jest składnikiem oleju gwajakowego, eukaliptusowego i gardenii ale otrzymujego go na drodze syntezy. Jest on substancją niskotopliwą, przechodzącą w temperaturze około 300 stopni Celsjusza w niebieski olej, mieszający się z wazeliną, alkoholami, węglowodorami, tłuszczami, olejami mineralnymi, olejkami eterycznymi i tłuszczem wełny owczej. Nie rozpuszcza się zaś w wodzie oraz glicerynie. Ma podobne działanie oraz właściwości fizykochemiczne do chamazulenu. Azuleny działają przeciwzapalnie, łagodząco, bakteriostatycznie, antyalergicznie, regenerująco, uspokajająco i pielęgnacyjnie.
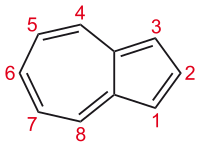
Źródło: Wikimedia. Cząsteczka Azulenu.
3) Borneol - jest to bicykliczny organiczny związek chemiczny z grupy terpenów, podgrupy kamfanów, stosowany jako środek zapachowy, przypominający kamforę. Występuje jako składnik wielu olejków eterycznych i jest naturalnym środkiem odstraszającym owady. Borneol może być zsyntetyzowany przez redukcję kamfory w reakcji Meerweina - Ponndorfa - Verleya. Ta sama redukcja, ale zachodząca szybciej i nieodwracalnie z borowodorkiem sodu daje izoborneol jako kinetycznie kontrolowany produkt reakcji.
Źródło: Wikipedia.
3) Cytral - jest to organiczny związek chemiczny z grupy aldehydów, produkt utlenienia geraniolu lub nerolu z grupy niepierścienowych terpenów. Związek ten posiada intensywny zapach przypominający cytrynę. Posiada dwa izomery geometryczne - E (inaczej trans), zwany jako "cytral a" (lub gerenial) i Z (inaczej cis) czyli "cytral b", zwany również neralem. W naturze występuje jako mieszanina izomerów. Pod wpływem kwasu siarkowego tworzy się z niego mieszanina cyklicznych alkoholi. Cytral jest składnikiem wielu olejków eterycznych, znajduje się w olejku cytrynowym, w olejku lemongrasowym (olejek pozyskiwany z trawy cytrynowej) gdzie stanowi 80% jego składu, zaś w olejku z liści tropikalnej rośliny Backhousia citridora jego udział przekracza 90%.
Źródło: Wikipedia.
4) Egzaltolid (lakton kwasu 15-hydroksypentadekanowego) - jest to makrocykliczny związek zapachowy, stosowany w produkcji perfum do utrwalania i harmonizowania zapachu. Ma zapach przypominający piżmo (z nutą ambry), dzięki czemu może być zamiennikiem tych naturalnych substancji zapachowych pochodzenia zwierzęcego, zawierających podobne związki wielkopierścieniowe (np. muskon, cyweton, ambretolid).

Źródło: Wikipedia.
5) Eugenol - jest to organiczny związek chemiczny z grupy terpenów. Jest 4-allilową pochodną gwajakolu. Utleniając eugenol można otrzymać wanilinę, co jest jedną z podstawowych metod jej otrzymywania w przemyśle. Eugenol jest związkiem zapachowym, będącym podstawowym składnikiem olejku z goździków (72-90%). Występuje także w cynamonie. Jest to bezbarwna, oleista ciecz o przyjemnym ostrym zapachu kojarzącym się z goździkami. Posiada także właściwości antyseptyczne (odkażające) i znieczulające, dzięki czemu jest wykorzystywany w dentystyce do odkażania kanałów zębowych oraz w mieszaninie z tlenkiem cynku jako cement dentystyczny. Jest także stosowany jako plastyfikator niektórych tworzyw sztucznych. Eugenol ma działanie pobudzające i jest szkodliwy. W teście Draizego u królika wywołuje silne podrażnienie skóry. Stężenia stosowane w dentystyce i przemyśle perfumeryjnym są wielokrotnie niższe od jego progu szkodliwości.
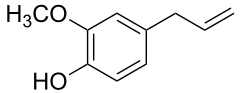
6) Farnezol - jest to organiczny związek chemiczny, alkohol z grupy terpenów, stosowany głównie jako środek zapachowy o zapachu konwalii. Jest składnikiem wielu olejków eterycznych, m.in. konwaliowego, lipowego, muszkatołowego i akacjowego. Otrzymuje się go z olejków kwiatu lipy. Stosowany jest w przemyśle perfumeryjno - kosmetycznym.

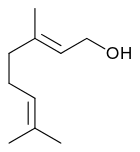
7) Geraniol - jest to organiczny związek chemiczny z grupy nienasyconych alkoholi terpenowych. Występuje w olejkach eterycznych. Ma intensywny zapach kojarzący się ze świeżością i pelargoniami, dlatego stosuje się go często w wieli kompozycjach zapachowych stosowanych w perfumach. Jest głównym składnikiem olejku różanego, pelargoniowego i cytrynowego. Jest izomerem geometrycznym (o konfiguracji trans) nerolu.
8) Indol (2,3-benzopirol) - jest to heterocykliczny związek chemiczny, zbudowany ze sprzężonych pierścieni benzenowego i pirolowego. Zarówno wyjściowy indol, jak i bardziej złożone związki zawierające grupę indolową są powszechnie spotykane w tkankach żywych organizmów, zarówno zwierząt, jak i roślin. Grupa indolowa występuje też jako szkielet wielu substancji zanjdujących się w ludzkich ciele, jak np. aminokwas tryptofan lub serotonina. Nazwa "indol pochodzi od nazwy barwnika indygo, zawierającego dwie grupy indolowe. Jest to związek o bardzo nieprzyjemnym zapachu. Występuje w kale oraz w małych stężeniach w perfumach. Wytwarzany jest przez różne drobnoustroje np. z rodziny Enterobacteriaceae. Zdolność wytwarzania indolu jest jedną z metod identyfikacji drobnoustrojów z tej rodziny. Wiele alkaloidów to pochodne indolu.

Źródło: Wikipedia. Cząsteczka indolu.
9) Jasmon - jest to naturalny organiczny związek chemiczny uzyskiwany z oleju z kwiatów jaśminu. Kolor przybiera od bezbarwnego do bladego żółtego; ciecz ma woń jaśminu. jasmn może występować w dwóch izomerycznych formach różniących się geometrią wokół podwójnego wiązania łańcucha pentenylu: cis-jamon i trans-jasmon. Naturalny ekstrakt zawiera tylko formę cis, przy czym materiał syntetyczny jest często mieszaniną zawierającą obie formy z przewagą cis. Komercyjnie jasmon jest wykorzystywane głównie do produkcji perfum i kosmetyków.
Źródło: Wikipedia.
10) Kamfen - jest to organiczny związek chemiczny, dwupierścieniowy terpen. Stanowi on krystaliczne ciało stałe o zapachu kamfory. Właściwie jest nierozpuszczalny w wodzie; łatwo rozpuszcza się w rozpuszczalnikach organicznych, etanolu czy eterze dietylowym. Występuje w postaci dwóch enacjomerów: l i d. W temperaturze pokojowej szybko sublimuje. Kamfen to jedyny naturalny węglowodór o wzorze sumarycznym C10H16 będący w temperaturze pokojowej ciałem stałym. Jest to naturalny składnik wielu olejków eterycznych. W postaci krystalicznej l-kamfen został wyizolowany m.in. z olejku eterycznego ze świerków czy z pierwszych frakcji olejku cytroelowyego (chemotyp cejloński); występuje także w olejku z gałązek Juniperus phoenicea (gatunek jałowca - Jałowiec fenicki), olejku nerolowym, walerianowym, cytrynowym, w Artemisia alba (gatunek bylicy) czy w Chrystanthemum japonicum (gatunek złocienia). d-kamfen występuje w olejku cyprysowym, także w świerkowym, imbirowym, muszkatołowym, cytrynowym, pomarańczowym, w kamforze, w petitgrain (z liści drzewa pomarańczowego olejku), czy w kwiatach eukaliptusa gałkowego. Ponadto kamfen został odnaleziony w olejkach z jagód jałowca, jedlicy, rozmarynu, fenkułu włoskiego, Citronella i olejku cynamonowego oraz bergamotowego. Kamfen przemysłowo otrzymywany jest na drodze katalitycznej izomeryzacji alfa-pinenu. Wykorzystywany jest jako związek zapachowy i smakowy, do maskowania nieprzyjemnych zapachów, a także jako półprodukt do produkcji kamfory.
W połowie XIX wieku stosowany (rozpuszczony w alkoholu) jako paliwo do lamp, uzyskał spory udział w rynku, będąc konkurencją dla używanego wtedy spermacetu czy oleju wielorybiego, dając równie jasny płomień i będąc tańszym w produkcji. Jego wadą była wybuchowość, co wytykali jego przeciwnicy, a zwolennicy olejów wielorybich. Sugerowano nawet, że rząd amerykański powinien objąć kamfen szczególną kontrolą, podobnie jak składy prochu. Wskazywano także na fakt, że paląc się szybciej niż olej wielorybi, zużywano go więcej, zatem tańsza produkcja była niwelowana jego większym zużyciem. Dodatkowo z powodu swojego szybkiego spalania, jeśli nie zapewniono dostatecznego dostępu tlenu, kamfen spalał się niecałkowicie, wytwarzając dużo sadzy. Kamfen jest także składnikiem leków stosowanych w dolegliwościach wątrobowo-żółciowych i nerkowych, w których składzie figuruje pod łacińską nazwą camphenum.
11) Karwon - jest to organiczny związek chemiczny z grupy terpenów, podgrupy monoterpenów zaliczany do monocyklicznych nienasyconych ketonów terpenowych. Jest to bezbarwna ciecz o temperaturze wrzenia 230 stopni Celsjusza. Ma jedno centrum chiralności i występuje w dwóch odmianach enancjomerycznych różniących się zapachem: (S)-(+)-karwon ma zapach kminku, a (R)-(-)-karwon - mięty. Jest rozpowszechniony w przyrodzie. Np. (S)-karwon wraz z (R)-limonenem są głównymi składnikami olejku kminkowego, a (R)-karwon występuje w mięcie zielonej. (S)-Karwon otrzymuje się z olejku kminkowego przez ekstrakcję. Można też go otrzymać przez destylację z parą wodną suszonych nasion kminku. Oba enancjomery można otrzymać w sposób stereospecyficzny z odpowiednich enancjomerów limonenu: (S)-limonen -> (S)-karwon; (R)-limonen -> (R)- karwon.
12) Linalol (3,7-dimetylooktadi-1,6-en-3-ol) - organiczny związek chemiczny, nienasycony alkohol alifatyczny, należący do grupy terpenów, posiadający intensywny zapach konwalii. jest mieszaniną dwóch stereoizomerów: likareolu i koriandrolu. Otrzymuje się go z olejków eterycznych: linalowego, kolendrowego, pomarańczowego i innych, lub syntetycznie. Produkowany jest przez różne rodziny, m.in. jasnotowate (bazylia, mięta), wawrzynowate (wawrzyn, cynamon) i rutowate (cytrusy), a także brzozy. Ma szerokie zastosowanie w przemyśle perfumeryjnym jako środek zapachowy lub w postaci octanu linalolilu. Używany jest też jako insektycyd.

13) Mentol - jest to alkohol z grupy terpenów, o ostrym, przenikliwym zapachu miętowym, stosowany masowo w przemyśle kosmetycznym i pomocniczych środkach farmaceutycznych. Mntol jest wyodrębniany głównie z mięty pieprzowej i innych gatunków mięty. Jest on jednym ze składników wielu olejków eterycznych innych roślin. W temperaturze pokojowej tworzy białe, igłowe kryształki. Słabo rozpuszczalny w wodzie, dobrze rozpuszcza się w polarnych rozpuszczalnikach organicznych. Ze względu na to, że zawiera on 3 centra chiralności, ma 8 izomerów optycznych, z których 4 występują w naturze, a 4 zostały otrzymane na drodze syntetycznej (tzw. neomentole). Najczęściej spotykany naturalnie jest (-)-mentol (o konfiguracji absolutnej 1R,2S,5R), występujący m.in. w mięcie pieprzowej. Wykazuje on najsilniejsze działanie biologiczne.
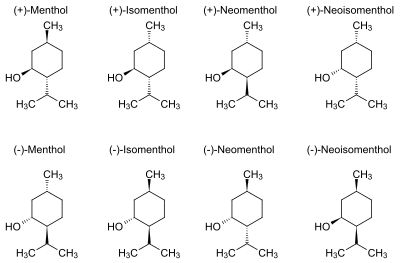
Źródło: Wikipedia. Izomery Mentolu.
Mentol ma własności znieczulające i zmniejszające podrażnienie błon śluzowych. Jego wdychanie lub spożywanie daje szybko odczuwalne wrażenie chłodu i świeżości. Jest stosowany w specyfikach wspomagających leczenie przeziębień i kataru. Jest także dodawany do maści na ból mięśni, aromatyzuje się nim chusteczki higieniczne, papierosy, tabaki, proszki do prania, płyny do mycia naczyń, itp. Jest także stosowany jako jeden ze składników wielu kompozycji zapachowych stosowanych w kosmetyce. Zaaplikowany na dolną powiekę wywołuje łzawienie oczu, przez co znajduje zastosowanie w aktorstwie i modelingu. W syntezie chemicznej mentol i jego pochodne wykorzystywane są jako pomocniki i katalizatory chiralne.
14) Menton - jest to organiczny związek chemiczny, przykład terpenoidu zawierającego grupę karbonylową C=O. Towarzyszy on mentolowi i limonenowi w olejkach miętowych. Można go otrzymać w wyniku utlenienia mentolu. W przyrodzie występują jego 4 diastereoizomery: (+) - menton (2R, 5S), (-)-menton (2S, 5R), (+)-izomenton oraz (-)-izomenton, (-)-izomenton jest składnikiem olejku z mięty polnej, natomiast (+)-menton znajduje się w olejku z Micromeria biflora (janotowate). (-)-Izomenton występuje w olejku geraniowym, a (+)-izomenton w olejku z rośliny Micromeria abyssinica.
15) Nerol - jest to organiczny związek chemiczny, terpen występujący w olejkach eterycznych: bergamotowym i nerolowym. Ma zapach róży. Jest izomerem geometrycznym (o konfiguracji cis) geraniolu. Jest stosowany w przemyśle perfumeryjnym.
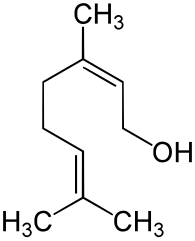
16) alfa -Pinen - jest to organiczny związek chemiczny z grupy cyklicznych monoterpenów. Jest głównym składnikiem terpentyny otrzymywanej z żywicy sosnowej. Stosowany jest w kosmetyce jako składnik perfum oraz jako surowiec do otrzymywania innych środków zapachowych, np. alfa-terpinolu, limonenu lub bergaptolu.
 Z lewej enacjomer 1 S, 5 S, a z prawej 1 R, 5 R. Z lewej enacjomer 1 S, 5 S, a z prawej 1 R, 5 R.
IZOMERY: alfa - Pinen ma dwa enancjomery, (+)=(1 R, 5 R)-alfa-pinen oraz (-)-(1 S, 5 S)-alfa-pinen, obydwa występują w naturze w olejkach eterycznych wielu roślin, głównie iglastych. Znanych jest także kilka izomerów konstytucyjnych pinenu, różniących się między sobą położeniem wiązania podwójnego. Każdy z nich ma dwa enancjomery, oznaczone zwyczajowo (+) i (-).

Źródło: Wikipedia. Główne reakcje z udziałem alfa - Pinenu.
17) Salicylan metylu - jest to organiczny związek chemiczny z grupy estrów, ester metylowy kwasu salicylowego. Bezbarwna lub żółtawa ciecz o silnej, charakterystycznej woni. Związek znalazł zastosowanie w lecznictwie. Stosowany miejscowo na nieuszkodzoną skórę jako lek przeciwbólowy, przeciwzapalny i rozgrzewający. Używany jest również jako półprodukt w różnych syntezach chemicznych.
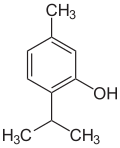
18) Tymol (2-izopropylo-5-metylofenol) - jest to organiczny związek chemiczny z grupy yerpenoidów i fenoli. Jest on obok swojego izomeru karwakrolu składnikiem olejków eterycznych występujących w macierzance (tymianku), lebiodce (oregano) i cząbrze. Tworzy bezbarwne kryształy o charakterystycznym silnym zapachu macierzanki. W Starożytnym Egipcie tymol oraz karwakrol były używane ze względu na ich właściwości bakterio- i grzybobójcze przy mumifikacji. Tymol w postaci krystalicznej został odkryty w roku 1719 przez Caspara Neumanna - niemieckiego duchownego i uczonego z Wrocławia, a w roku 1842 opisany na podstawie analizy elementarnej przez M. Lallemanda, który w sposób prawidłowy przedstawił stosunek węgla, wodoru i tlenu w tymolu. Analiza krystalograficzna z dokładnym określeniem pozycji atomów została wykonana dopiero w roku 1980. Ciśnienie pary nasyconej wynosi 2,5 hPa przy 25 stopniach Celsjusza. Tymol jako derywat fenolu ma właściwości typowe dla fenolu. Jest trudno wchłaniany z przewodu pokarmowego, dlatego stosowany był jako środek przeciw robaczycy, a także do odkażania błon śluzowych. Jest silną trucizną komórkową. Uszkadza wątrobę, nerki, serce i ośrodkowy układ nerwowy. Jedną z metod jego otrzymywania jest rakcja m-krezolu i propenu. Proces został opracowany w roku 1927 przez Karla Schoellkopfa z firmy Rheinische Kampfer Fabrik. Reakcję prowadzi się w obecności katalizatorów kwasowych w temperaturze 170-230 stopni Celsjusza. Tymol stosowany jest jako środek dezynfekujący. W pszczelarstwie znajduje zastosowanie do zwalczania warrozy (choroba wywoływana przez roztocz Varroa destructor rozwijającą się na czerwiu i dorosłych osobnikach pszczół miodnych).
Źródło: Wikipedia.
Ilościowe proporcje między składnikami olejków eterycznych zależą od gatunku rośliny i części poszczególnych roślin (np. kwiaty, liście, łodygi). W ramach gatunku są zmienne w przestrzeni i czasie (utrudnia to utrzymanie efektywnej interakcji z zapylaczami, jeżeli nie są dostosowane do tych zmian). Zależą od warunków środowiska, m.in. takich czynników, jak nasłonecznienie lub pH i inne cechy gleby. Poniżej zamieszczono przykładowe zestawienie niektórych cech olejku goździkowego.
Najwięcej uwagi poświęcano badaniom składu olejków o zapachu przyjemnym dla ludzi, np. wykorzystywanych do produkcji perfum lub aromatów spożywczych, podczas gdy rośliny wabiące owady często wydzielają lotne związki pachnące nieprzyjemnie. Należą do nich np. barszcz zwyczajny (Harecleum sphondylium), ciemiernik cuchnący (Helieborus foetidus) i obrazki plamiste (Arum maculatum L.). Uwalnianie do środowiska takich substancji jest konsekwencją koewolucji roślin z owadami żerującymi na gnojowicy, oborniku, odpadach komunalnych lub padlinie. Nieprzyjemny zapach wabi również aktywne nocą ćmy i nietoperze.
W tej grupie związków wymienia się np. tiole, tioetery i inne związki siarkoorganiczne (często o zapachu przypominającym zepsute jaja, cebulę lub czosnek) oraz związki azotu, np. metyloamina, etyloamina, propyloaminam putrescyna, kadaweryna, indol, skatol i inne (zapach ryby lub zapach kału).
Kwiaty roślin takich, jak np. Arum nigrum i Arum maculatum (Pałczycha) uwalniają lotne związki o zapachu kału, wabiące żuki gnojowe i muchy (uwalnianiu się odorantów sprzyja podgrzewanie wnętrza pochwy kwiatostanu w wyniku wykorzystania alternatywnej drogi oddechowej). Zwabione owady (AOX - ang. alternatice oxidase - oksydaza alternatywna). Zwabione owady spadają do wnętrza pochwy, której wewnętrzne ścianki pokryte są oleistą wydzieliną. Próbując przez około 24 godziny wydostać się z pułapki, przenoszą pyłek na kwiaty żeńskie. W niektórych mieszaninach emitowanych przez część kwiatów bywają identyfikowane dodatkowo związki o działaniu narkotycznym lub usypiającym, co zwiększa prawdopodobieństwo efektywnego wykorzystania schwytanego zapylacza.
Z podobnych metod chwytania owadów korzysta człowiek, np. ustawiając w sadach pułapki feromonowe (działania człowieka inspirowane umiejętnościami roślin - czyżby były one od nas bardziej inteligentne, wytworzyły niegdyś lepsze narzędzia w drodze ewolucji?). W części z nich jest stosowany ester metylowy eugenolu - związek bardzo skutecznie wabiący samce orientalnej muszki owocowej Dacus dorsalis. Jest on zarówno feromonem płciowym tych owadów, jak atraktantem wytwarzanym przez kwiatostany i liście Cassia fistulosa (Leguminosae) oraz kilku innych roślin.
O podobnym zjawisku wspomniano wcześniej, opisując przypadek przywabiania samców dzikich pszczolinek (Andrena) do kwiatów storczyka z rodzaju dwulistnik (Ophrys), które nie wytwarzają nektaru. W skład wabiących substancji zapachowych Ophrys wchodzą krótkołańcuchowe związki alifatyczne, monoterpeny i dwupierścieniowe seskwiterpeny z serii kadinenu (te same związki zidentyfikowano w ekstrakcie z gruczołów płciowych samic pszczolinek).
NEKTAR: Wabienie zapylaczy jest jedynym celem wytwarzania nektaru przez rośliny. Jest on wykorzystywany przez wiele gatunków zwierząt - nie tylko zapylaczy, dla których jest on jedynym źródłem pożywienia, np. dla motyli. Nektary są zwykle roztworami cukrów (15-75% suchej masy), w tym:
Wykazano istnienie wielkiego zróżnicowania względnych udzałów trzech podstawowych cukrów pomiędzy gatunkami roślin okrytonasiennych (badania, wykonane w roku 1960, obejmowały 900 gatunków), jednak udziały te są wybitnie stałe, niezależne od pory dnia, sezonu lub wieku rośliny. Porównując gatunkowy skład 3 grup roślin, w których nektarze:
Prawdopodobnie na początku ewolucji okrytonasiennych ich nektar zawierał głównie sacharozę. Nowe gatunki, o zmniejszającym się udziale sacharozy, dostarczały zapylaczom coraz większe ilości cukrów łatwiej przyswajalnych - glukozy i fruktozy. Okazało się również możliwe stwierdzenie, które gatunki zapylaczy preferują nektar o różnym stosunku masy sacharozy do sumy mas heksoz, np. > 0,5 - duże pszczoły, kolibry, motyle; < 0,5 - małe pszczoły, ptaki wróblowate, nietoperze neotropikalne. Badając zawartości innych grup związków chemicznych w nektarach różnych okrytonasiennych stwierdzono m.in. że zwykle nie zawierają białka (śladowe ilości stwierdzono w 14% próbek); zawierają małe ilości aminokwasów, lecz wystarczające dla zaspokojenia zapotrzebowania motyli na azot; 49 gatunków w pięciu rodzinach roślin zapylanych przez pszczoły zawiera lipidy.
Niektóre nektary zawierają toksyny, prawdopodobnie pochodzące z innych części roślin. Toksyczność nektaru i pyłku dla pszczół jest niekiedy związana z obecnością mannozy, której pszczoły nie metabolizują. Zatrucia pszczół mogą również powodować zawarte w nektarze alkaloidy pirolizynowe (mogą one znaleźć się w miodzie, spożywanym przez ludzi). Niektóre motyle Ameryki Południowej wykorzystują te alkaloidy do wytwarzania feromonów. Badania wpływu chemicznego składu nektaru na jego atrakcyjność dla owadów są prowadzone również w sztucznych warunkach laboratoryjnych. Jednym z tematów takich badań jest wpływ stężenia kofeiny - jednego z alkaloidów purynowych - na atrakcyjność roztworów cukru dla pszczół. Kofeina wpływa na działanie układu nerwowego dzięki zmianom przepuszczalności jonów wapnia przez błony komórkowe (pod jej wpływem pająki przędą pajęczyny znacznie odbiegające od normy). Jest w przyrodzie wytwarzana m.in. w tkankach kawowca - częściowo chroni jego liście i nasiona przed zgryzaniem. Alkaloid ten występuje również w nektarze kawowca i niektórych cytrusów. W wyniku badań laboratoryjnych stwierdzono, że pszczoły trzykrotnie częśćiej odwiedzają roztwory fruktozy po dodaniu do nich niewielkiej ilości kofeiny (ich reakcje na wyższe stężenia alkaloidu są odwrotne). W warunkach naturalnych rośliny wytwarzające nektar o niewielkiej zawartości kofeiny są szybciej zapylane. Przypomina to zjawiska uzależnień człowieka od używek i innych substancji psychotropowych poprawiających nastrój (zdefiniowanie pojęć nastrój, przyjemnosć, euforia jest trudne nawet w odniesieniu do ludzkiej psychiki, jednakże wiadomo iż owe nastroje leżą u podstaw uzależnień). Metabolity wtórne, w tym alkaloidy i fenole, a także białka obecne w nektarze służą również ochronie przed organizmami niemutualistycznymi, zwierzętami i mikroorganizmami korzystającymi z wydzieliny bez korzyści dla rośliny.
PYŁEK:
|

























Brak komentarzy:
Prześlij komentarz