Zwijanie białka (zwane również fałdowaniem białka) - to proces fizyczny polegający na formowaniu przez polipeptyd (posiadający strukturę kłębka statystycznego (w fizyce polimerów - rzeczywistej struktury jaką tworzą pojedyncze cząsteczki polimerów w roztworze rzeczywistym lub w stanie gazowym) wysoko zorganizowanej struktury o charakterystycznej i stabilnej konformacji. Przyjmuje się, że każde białko tuż po zakończeniu translacji występuje pod postacią nieustrukuryzowanego łańcucha polipeptydowego. Taki polipeptyd nie wykazuje obecności dobrze zdefiniowanej, stabilnej struktury przestrzennej. Dopiero na skutek interakcji pomiędzy sąsiednimi aminokwasami polipeptyd zaczyna przyjmować określoną konformację, określaną często mianem stanu "natywnego". Obecnie uważa się, że głównym czynnikiem decydującym o natywnej strukturze danego białka jest jego sekwencja aminokwasowa. Warto podkreślić, iż dla większości znanych białek prawidłowa struktura przestrzenna jest konieczna dla ich roli fizjologicznej. Niepowodzenie w przyjęciu oczekiwanej struktury zwykle prowadzi do powstania białka o odmiennych właściwościach, które może być nawet toksyczne dla organizmu (przykładem może być wiele białek prionowych). Wiele dowodów wskazuje na to, że pewne choroby neurodegeneracyjne wywołane są akumulacją białek o nieprawidłowej strukturze takich jak amyloidy, formujące długie włókna w komórkach.
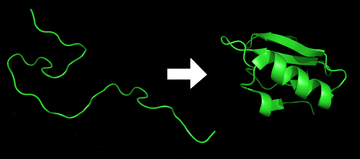 |
| Źródło: Wikipedia. Grafika przedstawia proces fałdowania białka. |
POZIOMY ORGANIZACJI OPISUJĄCE BUDOWĘ BIAŁEK:
I. Struktura pierwszorzędowa białka - jest to liniowy układ aminokwasów w łańcuchu polipeptydowym, zgodny z kodem genetycznym. Jest to pierwszy poziom organizacji strukturalnej, na którym można opisać budowę białka.
I. Struktura pierwszorzędowa białka - jest to liniowy układ aminokwasów w łańcuchu polipeptydowym, zgodny z kodem genetycznym. Jest to pierwszy poziom organizacji strukturalnej, na którym można opisać budowę białka.
II. Struktura drugorzędowa białka - jest to jeden z poziomów organizacji cząsteczki białka, który opisuje jej budowę. Określa się tu sposób przestrzennego ułożenia łańcuchów polipeptydowych białek na skutek powstawania wewnątrzcząsteczkowych wiązań wodorowych przede wszystkim między atomami tlenu grup amidowych i atomami wodoru innych grup amidowych. Łańcuchy polipeptydowe białek mogą układać się w kształt helisy (helis alfa, gdzie na jeden zwój heliksu przypada 3,6 aminokwasów, co odpowiada 0,54 nm), pofałdowanej płaszczyzny - harmonijki beta i beta zakrętu (pętli omega).
 |
| Źródło: Wikipedia. |
Helisa alfa jest stabilizowana przez wiązania wodorowe. Kształtem przypomina ona cylinder, tworzony przez ciasno, prawoskrętnie skręconą sprężynę. Ściany cylindra tworzy łańcuch polipeptydowy, zaś łańcuchy boczne (podstawniki) wystają na zewnątrz. Co cztery aminokwasy w łańcuchu polipeptydowym tworzone jest wiązanie wodorowe pomiędzy grupą karboksylową jednego aminokwasu a grupą aminową drugiego. Skok helisy następuje co 0,54 nm. Tego rodzaju alfa heliks przeważa np. w hemoglobinie i mioglobinie.
 |
| Źródło: Wikipedia. Przykładowa antyrównoległa harmonijka beta zbudowana z 4 łańcuchów polipeptydowych. a - widok z góry, b - widok z boku. |
Harmonijka beta (beta-kartka) - jest to jedna z możliwych struktur drugorzędowych białka. Ten sposób przestrzennego ułożenia aminokwasów w łańcuchu polipeptydowym przypomina wyglądem kartkę papieru pofałdowaną w harmonijkę. Kształt harmonijki beta stabilizowany jest przez wiązania wodorowe, które występują pomiędzy sąsiednimi łańcuchami - nićmi beta, będącymi prawie całkowicie rozciągniętymi fragmentami polipeptydowymi, zwykle o długości 5-10 aminokwasów. Występują harmonijki beta: równoległe, antyrównoległe i mieszane. Struktury te (w odróżnieniu od helis alfa zbudowanych z jednej ciągłej sekwencji) składają się z oddzielnych fragmentów łańcucha (nici beta), czasem znacznie od siebie oddalonych w sensie struktury pierwszorzędowej. Jeżeli nici beta są położone blisko siebie w łańcuchu aminokwasowym, to miejsce zwrotu nosi nazwę zakrętu beta.
 |
| Źródło: Wikipedia. Jest to schematyczne przedstawienie antyrównoległej harmonijki beta zbudowanej z jednego łańcucha polipeptydowego. Nici beta oznaczone są strzałkami szerokimi. Są one połączone z zakrętami beta.
Zakręt beta (zwrot beta) - jest to element strukturalny większości białek powodujący zmianę kierunku łańcucha polipeptydowego. Beta zakręt stanowi element drugorzędowej struktury białka. Dzięki zmianom kierunku łańcucha, cząsteczki białek są ściśle upakowane i mają globularne kształty. Zakręt beta o strukturze "spinki do włosów" powstaje wskutek tworzenia się wewnątrzcząsteczkowych wiązań wodorowych w łańcuchu polipeptydowym między atomem tlenu grupy karbonylowej C=O i atomem wodoru grupy amidowej NH dwóch reszt aminokwasowych oddalonych od siebie o ≥1 pozycji. Nazwa "zwrot beta" została przyjęta, ponieważ elementy te często łączą antyrównoległe nici beta w strukturach typu

Dla zobrazowania struktury drugorzędowej używa się w modelu wstęgowym charakterystycznych strzałek (dla harmonijki beta) oraz helis (dla helisy alfa).
III. Struktura trzeciorzędowa białka - jest to wzajemny układ w przestrzeni elementów struktury drugorzędowej, bez uwzględniania zależności od sąsiednich cząsteczek. Kształt, wielkość i właściwości danej podjednostki decydują o aktywności biochemicznej, w tym o działaniu enzymu. Warunkują ją różne wiązania chemiczne oraz oddziaływania międzycząsteczkowe, np:
Wiązania stabilizujące strukturę trzeciorzędową są dosyć słabe, dlatego znaczna większość białek to substancje wrażliwe na zmiany temperatury (termolabilne). W warunkach ustrojowych podniesienie temperatury powyżej 40-45 °C prowadzi do zniszczenia struktury trzeciorzędowej. Zachodzi wtedy proces denaturacji. Należy jednakże podkreślić, iż spora część białek (od 3% do ponad 30% w zależności od organizmu) w całości lub częściowo pozbawiona jest stabilnej struktury trzeciorzędowej. W komórce występują one jako białka w sposób ciągły zmieniające strukturę, adaptując się w ten sposób do środowiska.
Białka pozbawione struktury trzeciorzędowej (z ang. intrinsically unstructured proteins) to klasa białek w całości lub częściowo pozbawionych struktury trzeciorzędowej. Stan ten dotyczy białek w pełni funkcjonalnych i występuje w fizjologicznych warunkach. Odkrycie białek natywnie pozbawionych struktury trzeciorzędowej zakwestionowało jeden z podstawowych pradygmatów biologii strukturalnej białek, który mówi, że ściśle określona, stabilna struktura rzeciorzędowa jest niezbędna dla prawidłowej funkcji białka. Paradygmat ten nie dotyczy białek pozbawionych struktury trzeciorzędowej, które pomimo braku stabilnej struktury pozostają w pełni funkcjonalne. Z drugiej strony białka te czasem przybierają określoną strukturę trzeciorzędową, która jest częściowo narzucona przez inną makrocząsteczkę, z którą w danej chwili oddziaływują. Właśnie ta cecha (wysoka "elastyczność") pozwala niejako adaptować się białku do partnera. Z tej przyczyny białka te tworzą liczne interakcje z innymi białkami, oraz uczestniczą w procesach gdzie jest to niezbędne (np. kaskadach fosforylacji czy przekazywania sygnału). Na obecną chwilę jest znanych ponad 1500 białek w których w sposób eksperymentalny potwierdzono występowanie regionów nieuporządkowanych. Zebrane zostały one w bazę danych DISPROT. Regiony pozbawione struktury trzeciorzędowej (nieuporządkowane) są istotne także ze względów eksperymentalnych, ponieważ ich obecność często uniemożliwia otrzymanie struktur białek techniką krystalografii rentgenowskiej. W takim przypadku usunięcie regionów nieuporządkowanych niejednokrotnie umożliwia otrzymanie kryształów dobrej jakości dla pozostałego fragmentu białka. Z tego względu duże znaczenie ma komputerowe przewidywanie regionów pozbawionych struktury trzeciorzędowej. Na obecną chwilę istnieje około 60 programów tego typu, zaś ich dokładność sięga 80-90%.
Na poniższej grafice przedstawiono strukturę białka. Regiony na końcach nie posiadają ściśle zdefiniowanej struktury trzeciorzędowej i zmieniają swoje położenie, natomiast centralna część białka pozostaje w dużym stopniu stabilna. Źródło: Wikipedia.
IV. Struktura czwartorzędowa białka - jest to wzajemny układ w przestrzeni i sposób połączenia się podjednostek, czyli osobnych łańcuchów polipeptydowych, niepołączonych ze sobą kowalencyjnie lub grup prostetycznych (w przypadku białek złożonych). Tylko część białek tworzy strukturę czwartorzędową. Jeżeli jednak jest w stanie tworzyć to dopiero komplet podjednostek wykazuje aktywność biologiczną. Przykładami białek składających się z kilku podjednostek są: hemoglobina, polimeraza DNA, kanały jonowe, wirus mozaiki tytoniowej, dehydrogenaza białczanowa, dehydrogenaza alkoholowa.
Oddziaływania międzycząsteczkowe stabilizujące strukturę czwartorzędową są następujące:
Oddziaływania międzycząsteczkowe stabilizujące strukturę czwartorzędową są dość słabe, dlatego znaczna większość białek to substancje wrażliwe na zmiany temperatury (termostabilne). W warunkach ustrojowych podniesienie temperatury powyżej 40 °C- 45 °C prowadzi do zniszczenia struktury trzeciorzędowej. Zachodzi wówczas proces denaturacji.
INNE CECHY DOTYCZĄCE BUDOWY BIAŁEK:
I. Allosteria (allos - inny; steros - przestrzeń) - jest to zmiana powinowactwa chemicznego białka do cząsteczek (np. enzymów do substratów lub białek przenośnikowych do ich ładunku) przez zmianę struktury przestrzennej. Efekty allosteryczne odgrywają istotną rolę w regulacji aktywności enzymatycznej. Przykładem jest inhibicja allosteryczna, czyli obniżenie aktywności ktalitycznej enzymu w wyniku zmiany jego konformacji spowodowanej przyłączeniem się inhibitora do innego miejsca aniżeli miejsce aktywne.
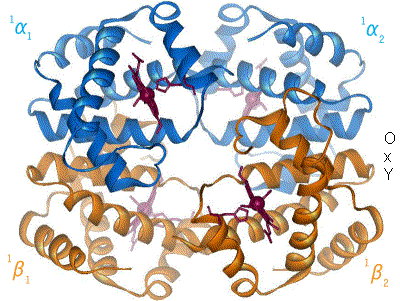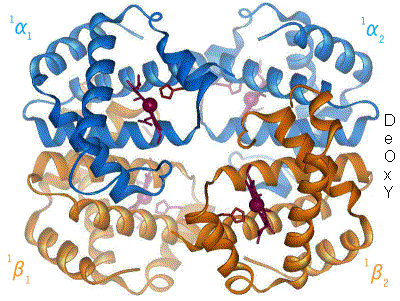
Poniższa grafika pokazuje hemoglobinę w stanach T (forma Deoxy) i R (forma Oxy). Przyłączenie jednej cząsteczki tlenu powoduje przejście hemoglobiny z formy T do formy R, co ułatwia przyłączanie się kolejnych cząsteczek tlenu. Źródło: Wikipedia.
II. Homodimery - homodimery to białka, których strukturę czwartorzędową tworzą dwa identyczne polipeptydy. Przykładem może być izoforma dysmutazy ponadtlenkowej: cytoplazmatyczna SOD-1 zawierająca miedź (Cu) i cynk (Zn) CuZnSOD-1 o masie cząsteczkowej podjednostek po 16 KDa.
III. Polimorfizm białek - jest to zjawisko występowania co najmniej dwóch form strukturalnych (tzw. izoform) danego białka. Polimorficzne enzymy określa się osobnym terminem - izoenzymy. Pomimorfizm białkowy i antygenowy znalazł zastosowanie w hodowli zwierząt. Poszczególne frakcje białka odróżnia się za pomocą elektroforezy na różnych nośnikach, np. elektroforezą na bibule ustalono u bydła dwa typy hemoglobiny A i B.
|


Brak komentarzy:
Prześlij komentarz