 |
| Źródło: wiemy.eu - Schemat ilustrujący budowę synapsy chemicznej. |
Najbardziej rozpowszechnionymi neuroprzekaźnikami są glutaminian, GABA, acetylocholina, noradrenalina, dopamina i serotonina. Ich działanie nakłada się na siebie wpływając na nasze emocje, funkcje poznawcze oraz nastrój.
W jaki sposób poziom neuroprzekaźników wpływa na nasze emocje? Poniższa grafika ilustruje schematycznie różnice w poziomie stężeń poszczególnych neuroprzekaźników i ich wpływ na towarzyszące człowiekowi uczucia, tudzież zaburzenia o charakterze psychicznym:
Innym sposobem ilustracji - tym razem nie tylko poziomu, ale również charakteru zmian (wzrost/spadek) stężeń neurohormonów jest tabela:
 |
| Źródło: mam-efke.pl |
 |
| Źródło: brief.pl - Na grafice przedstawiona jest tzw. chemia życia - stężenia neuroprzekaźników w układzie nerwowym regulują sposób naszej percepcji otoczenia, a także wpływają na nasz behawior. |
 |
| Źródło: doczesne.pl |
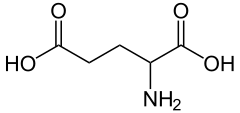 1) Glutaminian (łac. Acidum glutaminum) - Kwas glutaminowy jest aminokwasem o kwasowym charakterze, zaś glutaminianem zwiemy anion karboksylowy owego kwasu, który stanowi formę jego występowania w układach żywych. Kwas L-glutaminowy pełni bardzo istotną rolę, bowiem umożliwia przewodzenie impulsów nerwowych. Jako neuroprzekaźnik działa on pobudzająco w korze mózgowej ssaków.
1) Glutaminian (łac. Acidum glutaminum) - Kwas glutaminowy jest aminokwasem o kwasowym charakterze, zaś glutaminianem zwiemy anion karboksylowy owego kwasu, który stanowi formę jego występowania w układach żywych. Kwas L-glutaminowy pełni bardzo istotną rolę, bowiem umożliwia przewodzenie impulsów nerwowych. Jako neuroprzekaźnik działa on pobudzająco w korze mózgowej ssaków.
Kwas glutaminowy powstaje w wyniku syntezy z glutaminy przy udziale glutaminazy. Jest on w stanie połączyć się zarówno z receptorami jonotropowymi, jak i metabotropowymi, a za jego pośrednictwem przekazywane są bodźce wzrokowe, słuchowe oraz czuciowe. Do receptorów jonotropowych należą nie-NMDA i NMDA. Do otworzenia receptora NMA dochodzi poprzez przyłączenie glutaminianu oraz depolaryzację błony komórkowej. Powoduje to usunięcie jonów Mg2+ i wniknięcie jonów Ca2+. Dekarboksylacja kwasu glutaminowego prowadzi do powstania innego neuroprzekaźnika - GABA.
Glutamian stanowi podstawę procesu powstawania śladu pamięciowego. Ma wpływ na procesy uczenia się i pamięć. Wiąże się on również ze zjawiskiem plastyczności mózgu. Komunikacja między komórkami nerwowymi, które tworzą sieci pamięci zachodzi przy udziale sygnałów chemicznych, za których powstawanie są odpowiedzialne właśnie neurotransmitery. Glutaminian działa w tym przypadku za pośrednictwem jonowych receptorów NMDA, których pobudzenie rozpoczyna cykl przemian w komórce nerwowej, a w efekcie - przy współudziale innych neuroprzekaźników aktywujących czynniki transkrypcyje, prowadzi do nasilenia ekspresji genów. W hipokampie występuje największa ilość receptorów NMDA w mózgu, niezbędnych do tworzenia się śladów pamięciowych. Inaktywacja tych receptorów - prowadzi, rzecz jasna, do zaburzeń poznawczych.
W sytuacjach znacznego niedoboru GABA pojawiają się konwulsje, a nawet śmierć. To właśnie z tej przyczyny podanie dużej dawki czystego tujonu może doprowadzić do zgonu. Ratunkiem może być zwiększenie powinowactwa GABA w receptorach niezajętych przez tujon za pomocą agonistów receptora benzodiazepinowego, np. alkoholu etylowego.
 Acetylocholina - acetylocholina stanowi ester kwasu octowego i choliny. W żywych organizmach stanowi ona neuromediator, który syntezowany jest w neuronach cholinergicznych. Prekursor acetylocholiny stanowi cholina, która przenika z przestrzeni międzykomórkowej do wnętrza neuronów. Cholina ulega estryfikacji, czyli przyłączeniu reszty kwasu octowego do acetylocholiny przy udziale enzymu zwanego acetylotransferazą cholinową. Po utworzeniu się acetylocholiny, jest ona uwalniana z zakończeń presynaptycznych do przestrzeni synaptycznej przez dopływające impulsy nerwowe, a część jej jest magazynowana w ziarnistościach neuronów. Po wydzieleniu z zakończeń presynaptycznych acetylocholina działa na receptory znajdujące się w zakończeniach postsynaptycznych i jest bardzo szybko rozkładana przez enzym zwany acetylocholinesterezą. Jest to jedyny mechanizm unieczynniania acetylocholiny. Szybkość syntezy acetylocholiny zależy od stężenia choliny oraz acetylocholiny w neuronie. Związki fosfoorganiczne takie jak sarin i soman mają zdolność do inhibicji acetylocholinesterazy, co warunkuje ich toksyczność.
Acetylocholina - acetylocholina stanowi ester kwasu octowego i choliny. W żywych organizmach stanowi ona neuromediator, który syntezowany jest w neuronach cholinergicznych. Prekursor acetylocholiny stanowi cholina, która przenika z przestrzeni międzykomórkowej do wnętrza neuronów. Cholina ulega estryfikacji, czyli przyłączeniu reszty kwasu octowego do acetylocholiny przy udziale enzymu zwanego acetylotransferazą cholinową. Po utworzeniu się acetylocholiny, jest ona uwalniana z zakończeń presynaptycznych do przestrzeni synaptycznej przez dopływające impulsy nerwowe, a część jej jest magazynowana w ziarnistościach neuronów. Po wydzieleniu z zakończeń presynaptycznych acetylocholina działa na receptory znajdujące się w zakończeniach postsynaptycznych i jest bardzo szybko rozkładana przez enzym zwany acetylocholinesterezą. Jest to jedyny mechanizm unieczynniania acetylocholiny. Szybkość syntezy acetylocholiny zależy od stężenia choliny oraz acetylocholiny w neuronie. Związki fosfoorganiczne takie jak sarin i soman mają zdolność do inhibicji acetylocholinesterazy, co warunkuje ich toksyczność.
Ogólnie istnieją dwa typy receptorów cholinergicznych - nikotynowe (N), które wbudowane są w błonę komórki zwoju autonomicznego i muskarynowe (M), które występują w synapsach obwodowych zakończeń przywspółczulnych i są wbudowane w błonę komórki efektorowej.
Receptory nikotynowe N to białka receptorowe (białka łączące się z określoną inna substancją, którą zwiemy ligandem, gdzie ligandem jest np. neuroprzekaźnik) które mają strukturę pentameru (składają się z pięciu monomerów). Pentamerowa struktura zbudowana jest z różnych kombinacji genetycznie odmiennych jednostek α (1-10), β (1-4), γ, δ i ε. Większość efektów działania nikotyny w mózgu wynika z jej działania na system acetylocholinergicznych receptorów nikotynowych (NACh-R). Znanych jest wiele naturalnych związków, które posiadają zdolnosć do aktywacji NACh-R - można podać tu za przykład epibatydynę - alkaloid wydzielany przez żabę Epipedobates tricolor (drzewołaza trójbarwnego) - substancja ta była niegdyś przez Indian stosowana do przygotowywania zatrutych strzał i wykazuje ona właściwości przeciwbólowe niemalże 200 razy silniejsze aniżeli morfina, a w przeciwieństwie do niej nie wywołuje uzależnienia. Innymi przykładami mogą być arekolina (psychoaktywna substancja z grupy alkaloidów pirydynowych, która zawarta jest w orzechach palny arekowej - rośliny pochodzącej z Filipin, która uprawiana jest w krajach o tropikalnym klimacie jako roślina użytkowa, wszędzie tam gdzie istnieje tradycja żucia betelu - znanej od starożytności używki, która jest popularna w krajach takich jak Malezja i Madagaskar i stanowi czwartą najbardziej popularną używkę na świecie zaraz za kofeiną, nikotyną i alkoholem; sama arekolina może również być otrzymywana syntetycznie - wówczas otrzymuje się ją z kwasu nikotynowego. Arekolina jest silną trucizną i powoduje skurcze mięśni gładkich. Obecnie stosowana jest jako lek w weterynarii o działaniu przeciwko robakom. Działanie jej opiera się na tym, iż jest agonistą receptorów muskarynowych (parasympatykomimetykiem). Receptory te to kolejno: M1, M2, M3. Arekolina pobudza układ przywspółczulny i powoduje m.in. przyspieszenie perystaltyki przewodu pokarmowego, a także stymuluje czynność gruczołów wydzielniczych); kolejny związek: Lobelina (alkaloid piperydynowy, zatem zawierający układ piperydyny - cyklicznej aminy drugorzędowej, która zawiera sześcioczłonowy pierścień z jednym hereroatomem - azotem. Związek ten występował niegdyś w nasionach lobelii rozdętej, która była niegdyś stosowana w medycynie jako środek o działaniu wymiotnym i pobudzającym ośrodek oddechowy. Często podawano lobelinę palaczom, gdyż wywoływała wymioty tuż po zapaleniu papierosa. Ma jednakże działanie toksyczne, w związku z czym wycofana została z lecznictwa); kolejna substancja: cytyzyna (jest alkaloidem chonolizydynowym o silnych toksycznych właściwościach, który występuje we wszystkich częściach zlotokapu zwyczajnego - małego drzewa lub wysokiego krzewu, które należy do rodziny bobowatych - dawniej medycyna ludowa wykorzystywała nasiona tejże rośliny jako środek wymiotny i przeczyszczający przy leczeniu zaparć. Dziś lektyny (białka lub glikoproteiny wiążące węglowodany), które są pozyskiwane z jej nasion i ziela, są stosowane w analityce klinicznej do oznaczania grup krwi A, B i 0; cytyzyna została wyizolowana ze złotokapu przez A. Partheila w roku 1894. Działanie cytyzyny na autonomiczny układ nerwowy, głównie ośrodek oddechowy jest pobudzające. Pobudza ona rownież ośrodek naczynioruchowy i zwiększa wydzielanie adrenaliny przez rdzeń nadnerczy i powoduje podwyższenie ciśnienia krwi. Ze względu na podobieństwo sposobu działania do nikotyny stosuje się ją w niewielkich ilościach jako jej substytut w łagodzeniu objawów głodu nikotynowego podczas leczenia nikotynizmu. W Polsce na przykład jest ona dostępna w tabletkach po 1,5 mg pod nazwą handlową - Tabex i Desmoxan).
Nikotyna stanowi klasyczny przykład silnego agonisty acetylocholinergicznego receptorów nikotynowych.
Receptory muskarynowe to grupa receptorów metabotropowych (umiejscowionych w błonie komórkowej, które regulują funkcjonowanie kanałów jonowych i pod wpływem zewnątrzkomórkowego neuroprzekaźnika inicjują wtórną kaskadę sygnałów wewnątrz komórki, które oddziałują z kanałami jonowymi znajdującymi się w ich sąsiedztwie). Receptory muskarynowe zlokalizowane są na błonach komórkowych, których pobudzenie w organizmie przez acetylocholinę wiąże się z aktywacją białka G i fosforylacją GDP do GTP. Każdy receptor muskarynowy zbudowany jest z pojedynczego hydrofobowego białka, które posiada siedem odcinków śródbłonowych o strukturze helisy alfa. Acetylocholina przyłącza się do zewnątrzkomórowych części białka, powodując zmianę jego konformacji. Dzięki temu do drugiej i trzeciej pętli wewnątrzkomórkowej może się przyłączyć białko G, które aktywując się w ten sposób doprowadza do utworzenia z GDP - GTP, które związane z podjednostką alfa białka G tworzy aktywny kompleks, który aktywuje przekaźniki drugiego rzędu.
Istnieją następujące typy receptorów muskarynowych: M1, M2, M3, M4, M5.
Typ M1 - znajduje się przede wszystkim w komórkach ośrodkowego układu nerwowego, a także w neuronach obwodowego układu nerwowego i komórkach okładzinowych żołądka. Efektem jego działania jest depolaryzacja w zwojach układu autonomicznego i pobudzenie ośrodkowego układu nerwowego, co ma przypuszczalny wpływ na procesy zapamiętywania, a także skurcz mięśni gładkich przewodu pokarmowego i wzrost wydzielania soku żołądkowego.
Typ M2 - występuje w tkance mięśniowej typu sercowego, ale rownież w zakończeniach presynaptycznych obwodowego i środkowego układu nerwowego. Efektem jego działania jest skrócenie trwania potencjału czynnościowego oraz ujemny efekt dromotropowy (zwolnienie przewodzenia).
Typ M3 - występują na komórkach gruczołowych oraz mięśniówce gładkiej narządów wewnętrznych oraz naczyń krwionośnych. Efektem jego działania jest zwiększenie wydzielania gruczołów, np. ślinianek, gruczołów potowych lub oskrzelowych, skurcz mięśni gładkich, który zachodzi jednocześnie wraz ze wzrostem wydzielania tlenku azotu (II), który w efekcie powoduje rozszerzenie naczyń.
Typ M4 - znajdują się w ośrodkowym układzie nerwowym i czynnościowo odpowiadają receptorom M2.
Typ M5 - znajdują się w ośrodkowym układzie nerwowym i odpowiadają czynnościowo receptorom M3.
Receptory M1, M3 i M5 aktywują typ Gq białka G. Uwolnione w wyniku hydrolizy podjednostki βγ białka G aktywuje fosfolipazę C, która rozkłada difosforan fosfatydyloinozytolu(PIP2) na trifosforan inozytolu (IP3) i diacyloglicerol (DAG). IP3 uwalnia zarówno wewnątrzkomórkowe zasoby wapnia, jak i otwiera receptory wapniowe w błonie komórkowej, co prowadzi do wzrostu stężenia Ca2+ w cytoplazmie. W komórkach mięśniowych wywołuje to skurcz. Natomiast DAG aktywuje kinazę C i wyzwala kaskadę aktywującą szereg białek.
Receptory M2 i M4 aktywują białka typu Gi, które hamują aktywność cyklazy adenylowej. Spadem cAMP powoduje zaś zwiększenie przewodzenia przez kanały K+. Zwiększenie stężenia potasu z kolei hamuje przewodnictwo przez kanały wapniowe, które są zależne od potencjału. Pobudzenie receptorów muskarynowych jest w stanie aktywować kaskadę przemian kwasu arachidonowego i aktywować cyklazę guanylową.
Naturalnym agonistą wszystkich receptorów muskarynowych jest acetylocholina. Stwierdzono ponadto, że pewne substancje egzogenne są w stanie działać zarówno agonistycznie, jak i antagonistycznie na poszczególne typy receptorów.
Acetylocholina powoduje między innymi: rozszerzenie naczyń krwionośnych; obniżenie ciśnienia krwi; zwolnienie częstości akcji serca; zmniejszenie siły skurczu mięśnia sercowego; skurcze mięśni gładkich oskrzeli, jelit, a także pęcherza moczowego; zwężenie źrenic; pobudzenie zwiększania wydzielania gruczołów; wyzwolenie skurczu mięśni prążkowanych (receptory nikotynowe).
Ciekawym faktem jest to, iż jądra podstawne przodomózgowia jako neuroprzekaźnika używają acetylocholiny. Ich projekcje biegną do różnych miejsc kory i układu limbicznego - w tym hipokampa. Wysoki poziom acetylocholiny jest niezbędny do wykonywania operacji pamięci roboczej w owych obszarach i spada podczas snu. Ułatwia to rozprzestrzenianie się śladów pamięciowych poza hipokamp. Cholinergiczny charakter ma także jądro podstawne Meynerta - struktura kresomózgowia, która jest niezbędna dla integralności pamięci - jej uszkodzenie zaś doprowadza do amnezji.
Acetylocholina obecnie nie ma zastosowania leczniczego, ponieważ ma nieswoiste i zbyt toksyczne, a także bardzo krótkie działanie. Są natomiast stosowane inne estry choliny. Również stosowane są leki, które hamują acetylocholinesterazę - hydrolazę acetylocholinową, w skrócie AChE, która stanowi enzym rozkładający acetylocholinę. Acetylocholina jest rozkładana przez AChE na cholinę i resztę kwasu octowego, wg poniższej uproszczonej reakcji:
Acetylocholina -----acetylocholinosteraza----> cholina + reszta kwasu octowego
Leki hamujące acetylocholinosterazę zwiększają zatem pulę acetylocholiny dostępną dla organizmu. Przykładami leków tego typu są np. fizostygmina pozyskiwana z Bobotrutki trującej, zwanej również fasolą kalabarską - bobowatej rośliny tropikalnej z Afryki Zachodniej, która bywa uprawiana również w Indiach i Brazylii. Zawarta w niej fizostygmina jako inhibitor acetylocholinoesterazy powoduje pośrednie zwiększenie pobudzenia zakończeń parasympatycznych poprzez wzrost stężenia acetylocholiny w przestrzeniach presynaptycznych i poraża zwoje autonomiczne układu nerwowego. Następstwami są również spadek ciśnienia śródgałkowego, nasilenie perystaltyki jelit, skurcz mięśni gładkich niektórych narządów (np. pęcherza i oskrzeli). Swoje zastosowanie fizostygmina znalazła w okulistyce, gdzie stosowana jest jako lek (z wyboru) zwężający źrenice w jaskrze. Krople i maści do oczu zawierają jej stężenie 0,1 do 0,5%. Innym przykładem leku hamującego aktywność acetylocholiesterazy jest donezepil. Donezepil to swoisty i odwracalny inhibitor acetylocholinesterazy, którego główne działanie dotyczy poprawy funkcji poznawczych - szczególnie pamięci. Stosowany jest on często w leczeniu objawów otępienia. Kolejny przykład leku - Galantamina stanowi alkaloid izochinolinowy, który występuje naturalnie w cebulach i przebiśniegu. Działa on parasympatykomimetycznie zwiększając napięcie mięśni szkieletowych, powoduje skurcz oskrzeli i nasila wydzielanie potu i soków trawiennych, a także zwęża źrenice. Przenika on do OUN i ułatwia przewodnictwo nerwowe. Ma on zastosowanie w zwalczaniu chorób, które przebiegają z uszkodzeniem nerwów obwodowych i zaburzeniami w przekaźnictwie nerwowym, np. różnych postaciach otępienia, m.in. w chorobie Alzheimera. Usprawnia on również pamięć u osób zdrowych. Ze względu na działanie kurczące na mięśnie stosuje się go także w leczeniu pooperacyjnej atonii pęcherza moczowego oraz jelit, a także w zatruciach kurarą - trucizną, która wytwarzana jest z kory kilku gatunków kulczyby, z cebuli rośliny Burmannia lub ze śluzowatej substancji korzeni Cissus quadrialata. Kurara blokuje acetylocholinowe receptory nikotynowe występujące w synapsach nerwowo - mięśniowych mięśni szkieletowych. Używana jest ona na całym świecie, głównie przez Indian południowoamerykańskich, którzy wykorzystują jej toksyczne właściwości do zatruwania strzał do łuków i dmuchawek.
 Noradrenalina - jest to organiczny związek chemiczny z grupy katechoamin, który stanowi jednocześnie hormon zwierzęcy i neuroprzekaźnik, który wydzielany jest w części rdzeniowej nadnerczy oraz w miejscu sinawym (zwykle razem z adrenaliną). Noradrenalina - w ogólności - mobilizuje mózg i ciało do działania. Jej wydzielanie jest najniższe podczas snu, a wstanie zwiększa jej stężenie o 180%. Znacznie wyższe stężenie noradrenalina osiąga w sytuacjach stresu i niebezpieczeństwa, gdzie uczestniczy w wytwarzaniu tzw. reakcji walki lub ucieczki. W mózgu noradrenalina zwiększa czujność i pobudzenie; wspiera ona także czuwania, uwydatnia procesy zapamiętywania, wspomaga koncentrację, zwiększa lęk i niepokój. Często nadmiar noradrenaliny prowadzi do wystąpienia zaburzeń lękowych. W pozostałych częściach ciała noradrenalina przyspiesza rytm serca, zwiększa ciśnienie krwi, powoduje uwolnienie zmagazynowanej glukozy i zwiększa dopływ krwi do mięśni szkieletowych; redukuje ona także dopływ krwi do układu pokarmowego i hamuje opróżnianie pęcherza moczowego oraz aktywność motoryczną w przewodzie pokarmowym. W przypadku wystąpienia krytycznie niskiego ciśnienia krwi noradrenalina jest wstrzykiwana jako lekarstwo. Ponadto leki beta-adrenolityczne (grupa działających na receptory beta 1 i beta 2 adrenergiczne leków, które hamują aktywność układu współczulnego, jednocześnie wywierając działanie na niemalże cały organizm, które stanowią jedną z najważniejszych grup leków, które stosowane są w kardiologii, zwłaszcza w niedokrwiennej chorobie serca, a także w leczeniu nadciśnienia tętniczego) stosowane są przeciwko niektórym dolegliwościom układu krążenia, a także zaburzeniom psychicznej natury. Antagonizujące alfa - 2 posiadają działanie uspokajające i są stosowane do uwydatniania anestezji podczas operacji, jak również do leczenia uzależnienia alkoholowego i uzależnienia od narkotyków. Bupropion - związek chemiczny z grupy katynonów, jest powszechnie stosowany jako atypowy antydepresant. Zarówno osobno, jak i w kombinacji do wspomagania leków z gru p inhibitorów zwrotnego wychwytu serotoniny - stanowi on jedyny lek przeciwko depresji sezonowej, także do redukcji głodu nikotynowego i objawów ADHD, gdzie jako nieliczny nie powoduje przyrostu masy ciała i dysfunkcji seksualnych. Stanowi on inhibitor wychwytu zwrotnego noradrenaliny i dopaminy - analogicznie jak SSRI stanowi inhibitor zwrotnego wychwytu serotoniny. Ciekawostką jest to, iż w Stanach Zjednoczonych i w Kanadzie bupropion należy do najczęśćiej przepisywanych leków przeciwko depresji (zależnej od noradrenaliny), jak również - w dawkach niższych - dla utrzymania abstynencji od nikotyny. Jako selektywny inhibitor zwrotnego wychwytu noradrenaliny i dopaminy (stymulant) - stosowany jest również przeciwko ADHD, który jest zależny od noradrenaliny. Jest to ponadto jedyny skuteczny lek przeciwko depresji sezonowej.
Noradrenalina - jest to organiczny związek chemiczny z grupy katechoamin, który stanowi jednocześnie hormon zwierzęcy i neuroprzekaźnik, który wydzielany jest w części rdzeniowej nadnerczy oraz w miejscu sinawym (zwykle razem z adrenaliną). Noradrenalina - w ogólności - mobilizuje mózg i ciało do działania. Jej wydzielanie jest najniższe podczas snu, a wstanie zwiększa jej stężenie o 180%. Znacznie wyższe stężenie noradrenalina osiąga w sytuacjach stresu i niebezpieczeństwa, gdzie uczestniczy w wytwarzaniu tzw. reakcji walki lub ucieczki. W mózgu noradrenalina zwiększa czujność i pobudzenie; wspiera ona także czuwania, uwydatnia procesy zapamiętywania, wspomaga koncentrację, zwiększa lęk i niepokój. Często nadmiar noradrenaliny prowadzi do wystąpienia zaburzeń lękowych. W pozostałych częściach ciała noradrenalina przyspiesza rytm serca, zwiększa ciśnienie krwi, powoduje uwolnienie zmagazynowanej glukozy i zwiększa dopływ krwi do mięśni szkieletowych; redukuje ona także dopływ krwi do układu pokarmowego i hamuje opróżnianie pęcherza moczowego oraz aktywność motoryczną w przewodzie pokarmowym. W przypadku wystąpienia krytycznie niskiego ciśnienia krwi noradrenalina jest wstrzykiwana jako lekarstwo. Ponadto leki beta-adrenolityczne (grupa działających na receptory beta 1 i beta 2 adrenergiczne leków, które hamują aktywność układu współczulnego, jednocześnie wywierając działanie na niemalże cały organizm, które stanowią jedną z najważniejszych grup leków, które stosowane są w kardiologii, zwłaszcza w niedokrwiennej chorobie serca, a także w leczeniu nadciśnienia tętniczego) stosowane są przeciwko niektórym dolegliwościom układu krążenia, a także zaburzeniom psychicznej natury. Antagonizujące alfa - 2 posiadają działanie uspokajające i są stosowane do uwydatniania anestezji podczas operacji, jak również do leczenia uzależnienia alkoholowego i uzależnienia od narkotyków. Bupropion - związek chemiczny z grupy katynonów, jest powszechnie stosowany jako atypowy antydepresant. Zarówno osobno, jak i w kombinacji do wspomagania leków z gru p inhibitorów zwrotnego wychwytu serotoniny - stanowi on jedyny lek przeciwko depresji sezonowej, także do redukcji głodu nikotynowego i objawów ADHD, gdzie jako nieliczny nie powoduje przyrostu masy ciała i dysfunkcji seksualnych. Stanowi on inhibitor wychwytu zwrotnego noradrenaliny i dopaminy - analogicznie jak SSRI stanowi inhibitor zwrotnego wychwytu serotoniny. Ciekawostką jest to, iż w Stanach Zjednoczonych i w Kanadzie bupropion należy do najczęśćiej przepisywanych leków przeciwko depresji (zależnej od noradrenaliny), jak również - w dawkach niższych - dla utrzymania abstynencji od nikotyny. Jako selektywny inhibitor zwrotnego wychwytu noradrenaliny i dopaminy (stymulant) - stosowany jest również przeciwko ADHD, który jest zależny od noradrenaliny. Jest to ponadto jedyny skuteczny lek przeciwko depresji sezonowej.
Noradrenalina lub Norepinefryna (z łac. Norepinephrinum) jest silnym agonistą receptorów alfa-adrenergicznych, zaś na receptory beta 1 działa z podobną siłą co adrenalina, natomiast względnie słabiej działa na receptory beta 2 - powinowactwo noradrenaliny do receptorów alfa jest około 9 razy większe niż do receptorów beta. Wywiera ona przez to złożone działanie fizjologiczne, szczególnie na układ krążenia. Norepinefryna wywołuje z kolei silny wzrost ciśnienia tętniczego zarówno skurczowego, jak i rozkurczowego głównie w wyniku skurczu naczyń krwionośnych (zwłaszcza skóry, nerek, a także mięśni szkieletowych i wątroby), a także związanego z tym zwiększenia oporu obwodowego. Mimo stymulacji receptorów beta - adrenergicznych rytm serca ulega zwolnieniu wskutek odruchowego pobudzenia nerwu błędnego. Przepływ przez naczynia wieńcowe na ogół wówczas się zwiększa. Działanie metaboliczne noradrenaliny, tzn. uwalnianie wolnych kwasów tłuszczowych z adipocytów i proces glikogenolizy, czyli rozkładu glikogenu do glukozo-1-fosforanu (a także niewielkiej ilości glukozy), a także rozkurczające na mięśnie gładkie oskrzeli jest zbliżone do działania adrenaliny - występują one jednakże dopiero przy wysokich dawkach (nawet 10-20-krotnie większych). Noradrenalina drażni również zakończenia nerwów współczulnych w jelitach krótkotrwale obniżając napięcie toniczne ich ścian i hamuje ruchy robaczkowe. Noradrenalina ponadto jest głównym neuroprzekaźnikiem pozazwojowych włókien układu współczulnego i niektórych neuronów pnia mózgu. Wewnątrz pnia mózgu noradrenalina produkowana jest w miejscu sinawym (z łac. locus coeruleus) - jądrze pnia mózgu, które położone jest z tyłu mostu, które m.in. dzięki połączeniom z podwzgórzem bierze udział w wyzwalaniu reakcji stresowej. Gra ono rolę we wzmacnianiu zachowań lękowych, a także w zespole stresu pourazowego (PTSD). Silny stres bowiem zaburza działanie miejsca sinawego.
W nadnerczach znajduje się lewoskrętny izomer norepinefryny. Syntetyczny izomer prawoskrętny działa biologicznie słabiej.
 Dopamina (łac. Dopaminum) - stanowi ona organiczny związek chemiczny z grupy katecholamin. Stanowi ważny neuroprzekaźnik syntezowany i uwalniany przez dopaminergiczne neurony ośrodkowego układu nerwowego. Dopamina działa poprzez swoiste receptory (istnieje pięć opisanych podtypów), które są zlokalizowane w błonach presynaptycznej i postsynaptycznej. W zależności od miejsca swego działania dopamina odgrywa odmienną rolę. Np. w układzie pozapiramidowym (gdy układ piramidowy zajmuje się czynnościami, które wymagają skupienia (np. nauka nowego ruchu, ćwiczenia takie jak, np. jazda na łyżwach i nauka rysowania), to układ pozapiramidowy powoli przejmuje i automatyzuje czynności, które wcześniej znajdowały się pod kontrolą układu piramidowego) jest odpowiedzialna za napęd ruchowy, koordynację i napięcie mięśni - np. w chorobie Parkinsona występuje niedobór dopaminy. W układzie rąbkowym (limbicznym) odpowiedzialna jest za procesy emocjonalne, wyższe czynności psychiczne i w znacznie mniejszym stopniu procesy ruchowe. W podwzgórzu jest związana głównie z regulacją wydzielania hormonów, a szczególnie prolaktyny (stąd inną nazwą dopaminy jest prolaktostatyna - ang. prolactin ihibitory hormone - PIH) i gonadotropin. Dopamina syntezowana jest również w tkankach obwodowych (kanalikach nerkowych i nerkowych naczyniach krwionośnych, pęcherzykach płucnych, trzustce i naczyniach krwionośnych płuc i serca) i wykazuje tam autokrynną aktywność. Dopamina często opisywana jest jako "przekaźnik przyjemności", jednakże nie jest poparte to wieloma wiarygodnymi źródłami. Cechą bowiem większości substancji uzależniejących jest bezpośrednie lub pośrednie nasilenie dopaminergicznej impulsacji w układzie mezolimbicznym. Przejawia się to zwiększonym stężeniem dopaminy w jądrze półleżącym przegrody i kory orbitofrontalnej. Główne działanie kokainy polega na stymulowaniu wydzielania dopaminy w mózgu. Odstawienie substancji narkotycznej wywołuje patologiczne obniżenie stężenia dopaminy w tej strukturze mózgu, co objawia się dysforią, a także objawami głodu narkotykowego.
Dopamina (łac. Dopaminum) - stanowi ona organiczny związek chemiczny z grupy katecholamin. Stanowi ważny neuroprzekaźnik syntezowany i uwalniany przez dopaminergiczne neurony ośrodkowego układu nerwowego. Dopamina działa poprzez swoiste receptory (istnieje pięć opisanych podtypów), które są zlokalizowane w błonach presynaptycznej i postsynaptycznej. W zależności od miejsca swego działania dopamina odgrywa odmienną rolę. Np. w układzie pozapiramidowym (gdy układ piramidowy zajmuje się czynnościami, które wymagają skupienia (np. nauka nowego ruchu, ćwiczenia takie jak, np. jazda na łyżwach i nauka rysowania), to układ pozapiramidowy powoli przejmuje i automatyzuje czynności, które wcześniej znajdowały się pod kontrolą układu piramidowego) jest odpowiedzialna za napęd ruchowy, koordynację i napięcie mięśni - np. w chorobie Parkinsona występuje niedobór dopaminy. W układzie rąbkowym (limbicznym) odpowiedzialna jest za procesy emocjonalne, wyższe czynności psychiczne i w znacznie mniejszym stopniu procesy ruchowe. W podwzgórzu jest związana głównie z regulacją wydzielania hormonów, a szczególnie prolaktyny (stąd inną nazwą dopaminy jest prolaktostatyna - ang. prolactin ihibitory hormone - PIH) i gonadotropin. Dopamina syntezowana jest również w tkankach obwodowych (kanalikach nerkowych i nerkowych naczyniach krwionośnych, pęcherzykach płucnych, trzustce i naczyniach krwionośnych płuc i serca) i wykazuje tam autokrynną aktywność. Dopamina często opisywana jest jako "przekaźnik przyjemności", jednakże nie jest poparte to wieloma wiarygodnymi źródłami. Cechą bowiem większości substancji uzależniejących jest bezpośrednie lub pośrednie nasilenie dopaminergicznej impulsacji w układzie mezolimbicznym. Przejawia się to zwiększonym stężeniem dopaminy w jądrze półleżącym przegrody i kory orbitofrontalnej. Główne działanie kokainy polega na stymulowaniu wydzielania dopaminy w mózgu. Odstawienie substancji narkotycznej wywołuje patologiczne obniżenie stężenia dopaminy w tej strukturze mózgu, co objawia się dysforią, a także objawami głodu narkotykowego.
Cząsteczka dopaminy zawiera strukturę pirokatechiny (pierścień benzenowy z przyłączonymi dwoma grupami hydroksylowymi w pozycji orto) z przyłączoną grupą aminową poprzez łańcuch etylowy. Dopamina jest najprostszą możliwą katecholaminą do których należą także neuromediatory, np. adrenalina i noradrenalina. Obecność pierścienia benzenowego z przyłączoną grupą aminową grupuje ją także do pochodnych fenyloetyloaminy - rodziny do której należy wiele środków psychoaktywnych.
Dopamina należy do zasad organicznych. W kwaśnym środowisku dochodzi do uprotonowania grupy aminowej cząsteczki. Ta forma umożliwia wysoką rozpuszczalność w wodzie i względną stabilność, lecz może doprowadzić do utlenienia cząsteczki w przypadku ekspozycji na tlen lub inne oksydanty. W zasadowym środowisku nie dochodzi do tworzenia formy protonowanej. Jest ona słabiej rozpuszczalna i bardziej reaktywna. W celach leczniczych dopaminę podaje się w postaci chlorowodorku (formy uprotonowanej) z powodu jej zwiększonej rozpuszczalności oraz stabilności. W formie stałej chlorowodorek dopaminy jest bezbarwnym proszkiem.
Dopamina jest syntezowana przede wszystkim w neuronach i komórkach rdzenia nadnerczy. Szlak metaboliczny syntezy dopaminy jest następujący:
F-Fenyloalanina -> L-Tyrozyna -> L-DOPA -> Dopamina
Bezpośredni prekursor dopaminy, L-DOPA, może być tworzony pośrednio z aminokwasu fenyloalaniny lub bezpośrednio z tyrozyny. Aminokwasy te znajdują się w niemalże każdym białku, więc są łatwo dostępne z pożywienia. Chociaż dopamina również znajduje się w pożywieniu, to w przeciwieństwie do aminokwasów nie jest zdolna do przekraczania bariery krew-mózg. Z tego powodu musi być ona syntetyzowana w samym mózgu z prekursorów, aby wykazywać działanie neuroprzekaźnika. L-fenyloalanina jest przekształcana do L-tyrozyny przez enzym hydroksylazę fenyloalaninową z udziałem tlenu cząsteczkowego oraz tetrahydrobiopteryny jako kofaktorów. L-tyrozyna przechodzi w L-DOPA przy udziale enzymy hydroksylazy tyrozynowej wraz z tlenem, tetrahydrobiopteryną i żelazem (Fe2+) jako kofaktory. Enzym - dekarboksylaza aromatycznych L-aminokwasów (dekarboksylaza DOPA) przekształca L-DOPA do dopaminy z fosforanem pirydoksalu jako kofaktorem. Dopamina jest prekursorem w syntezie noradrenaliny i adrenaliny. Dopamina jest przekształcana do noradrenaliny przy udziale enzymu hydroksylazy dopaminowej przy udziale tlenu i kwasu askorbinowego jako kofaktorów. Adrenalina powstaje z noradrenaliny przy udziale N-metylotransferazy fenyloetanoloaminowej z S-adenozylometioniną jako kofaktorem. Brak jakiegokolwiek aminokwasu bądź też kofaktora w szlaku jest w stanie upośledzić syntezę dopaminy, noradrenaliny i adrenaliny.
Degradacja dopaminy odbywa się w sposób następujący: Dopamina jest rozkładana do nieaktywnych metabolitów przez zespół enzymów w kolejności: MAO - Monoaminooksydaza; COMT - Katecholo - O - metylotransferaza; dehydrogenaza aldehydowa. Oba izoenzymy monoaminooksydazy, MAO-A i MAO-B, mogą skutecznie metabolizować dopaminę. Głównym końcowym produktem rozkładu jest kwas homowanilinowy, który nie ma znanej funkcji biologicznej. Z krwiobiegu kwas homownilinowy jest filtrowany przez nerki i wydalany wraz z moczem. W badaniach klinicznych u schizofreników, pomiar poziomu kwasu homowanilinowego w osoczu używany jest do oszacowania poziomu aktywności dopaminy w mózgu. Trudności z wykorzystaniem tej metody są powiązane z rozkładem norepinefryny (noradrenaliny) również do kwasu homowanilinowego. Mimo iż dopamina jest normalnie rozkładana przez oksydoreduktazy, jest możliwe także utlenienie jej poprzez bezpośrednią reakcję z tlenem z wytworzeniem chinonów (organicznych związków chemicznych, które są cyklicznymi, nienasyconymi diketonami; wiele spośród owych związków jest związkami o intensywnym zabarwieniu - wiele spośród nich stosowanych jest jako substancje barwiące lub jako utleniacze w laboratoriach, ponieważ mają dobre właściwości utleniające) i wolnych rodników (atomów lub cząsteczek, które zawierają niesparowane elektrony). Prędkość owej przemiany może być zwiększona przez obecność jonów żelaza w środowisku reakcji. Chinony i rodniki wytworzone przez autooksydację dopaminy mogą być neurotoksyczne i badania wykazują, że są w stanie przyczyniać się do utraty komórek w chorobie Parkinsona oraz innych chorobach.
Dopamina wywołuje efekty poprzez przyłączanie się do odpowiednich receptorów powerzchniowych komórki. U ssaków zidentyfikowano pięć receptorów dopaminowych od D1 do D5. Wszystkie z nich są receptorami metabotropowymi sprzeżonymi z białkiem G (transmembranowymi receptorami metabotropowymi, które reagują na sygnały, które docierają do komórki za pośrednictwem neuroprzekaźników aktywując białko G, które jest związane z receptorem po drugiej stronie błony komórkowej), co oznacza, że działają one poprzez system przekaźników drugorzędowych. Receptory te jesteśmy w stanie podzielić na dwie rodziny: D1 - podobne i D2- podobne. Dla receptorów, które są zlikowalizowane na neuronach w układzie nerwowym aktywacja D1 - podobnych skutkować może pobudzeniem (poprzez otwarcie kanałów sodowych) lub inhibicję (poprzez otwarcie kanałów potasowych); z kolei efekt akwytacji receptorów D2 - podobnyh stanowi z reguły inhibicję docelowego neuronu. W związku z tym dopamina nie jest przekaźnikiem hamującym, bądź pobudzającym, ponieważ efekt na neuron będzie zależał od typów receptorów, które obecne są na jego błonie wywołujących wzrost lub też spadek poziomu drugiego przekaźnika (cAMP). Receptory D1 są najliczniejszymi receptorami w układzie nerwowym ludzi, następne są receptory D2, natomiast pozostałe, czyli D3, D4, D5 występują już znacznie rzadziej.
W mózgu dopamina pełni swe funkcje jako neuroprzekaźnik a także neuromodulator i jest ona kontrolowana przez zespół mechanizmów powszechnych dla neutransmiterów monoaminowych. Po syntezie, dopamina jest transportowana z cytozolu w pęcherzykach synaptycznych przez białko nośników substancji rozpuszczonych (SLC) - pęcherzykowy transporter monoaminowy, VMAT2. Dopamina jest przechowywana w tych pęcherzykach do momentu wydzielenia do szczeliny synaptycznej. W większości przypadków egzocytoza przekaźnika jest powodowana przez potencjał czynnościowy, lecz może być także spowodowana przez aktywację wewnątrzkomórkowego receptora TAAR1 (ang. trace amine-associated receptor). TAAR1 posiada wysokie powinowactwo do dopaminy, agonistów TAAR1 (pochodnych 2-fenyloetyloaminy, trypaminy) oraz pochodnych amfetaminy i rozmieszczony jest wzdłuż błony presynaptycznej neuronów. Aktywacja TAAR1 uruchamia przekaźnictwo komórkowe włączając w to aktywację kinazy białkowej A i C, których działanie doprowadza do wympompowania dopaminy z komórki oraz internalizację transportera dopaminy, co skutkuje zmniejszeniem wychwytu zwrotnego. Równocześnie agonisty receptora TAAR1 zmniejszają liczbę wyrzutów dopaminy z komórki.
W synapsie dopamina przyłącza się i aktywuje receptory dopaminowe. Mogą być to postsynaptyczne receptory, które zlokalizowane są na dendrytach lub autoreceptory zlokalizowane na błonie neuronu presynaptycznego Kiedy w neuronie postsynaptycznym jest wywołany potencjał czynnościowy, cząsteczka dopaminy szybko odłącza się od receptora, a następnie jest transportowana z powrotem do neuronu presynaptycznego poprzez wychwyt zwrotny przy udziale transportera dopaminowego lub przez błonowy transporter monoamin (PMAT). Gdy dopamina jest już w cytozolu, może zostać rozłożona przez oksydazę monoaminową lub ponownie wykorzystana przez zapakowanie do pęcherzyków przez białko VMAT2. W mózgu zewnątrzkomó®kowy poziom dopaminy jest regulowany poprzez dwa mechanizmy: toniczną i fazową transmisję. Fazowe uwalnianie dopaminy, jak większość transmiterów, jest powodowane potencjałem czynnościowym neuronów produkujących dopaminę. Toniczna transmisja dopaminy pojawia się wtedy, gdy małe jej ilości są wydzielane bez obecności potencjału czynnnościowego neuronu presynaptycznego. Toniczna transmisja jest regulowana przez różne czynniki, włączając w to aktywność innych neuronów i wychwyt zwrotny neuroprzekaźnika.
Działając w mózgu, dopamina odgrywa ważną rolę w kontroli motorycznej, układzie nagrody, motywacji, czuwaniu, wzmocnieniu, procesach poznawczych takich jak uwaga, pamięć, myślenie, rozwiązywanie problemów, a także takich funkcjach jak laktacja, orgazm i nudności. Neurony dopaminergiczne (produkujące dopaminę) są stosunkowo nieliczne - jest ich bowiem całkowicie około 400 tysięcy w ludzkim mózgu, zaś ich ciała komórkowe są zgrupowane w kilku niewielkich obszarach w mózgu. Mimo tego ich aksony łączą się z wieloma innymi strukturami mózgu wywołując na nie znaczny wpływ. Grupy neuronów dopaminergicznych zostały po raz pierwszy zobrazowane w 1964 przez Annica Dahlström i Kjell Fuxe, którzy oznakowali je literą "A" ("aminergic"). Grupy od A1 do A7 zawierają neurotransmiter - noradrenalinę, natomiast od A8 do A14 - dopaminę. Rejony, które zawierają grupy neuronów dopaminergicznych to istota czarna (A8 i A9), pole brzuszne nakrywki (A10), tylna część podwzgórza (A11), jądro łukowate (A12), warstwa niepewna (A13) i jądro okołokomorowe (A14).
Istota czarna stanowi część śródmózgowia, która wchodzi w skład jąder podstawnych - grupy jąder (skupisk ciał komórek nerwowych bez wypustek), które wysyłają projekcje do kory mózgowej, wzgórza i pnia mózgu). Składa się ona z dwóch części - wewnętrznej (część zbita) i zewnętrznej (część siatkowata). Neurony dopaminergiczne znajdują się głównie w części zbitej (A8) i jej okolicach (A9). U ludzi aksony neuronów dopaminergicznych rzutują się z części zbitej do prążkowia tworząc szlak nigrostriatalny, który odgrywa bardzo ważną rolę w kontroli funkcji motorycznych i nauki nowych umiejętności manualnych. Neurony te są szczególnie narażone na uszkodzenia, a kiedy znaczna ich liczba umrze dochodzi do parkinsonizmu Pole brzuszne nakrywki również znajduje się w śródmózgowiu. Większa część aksonów neuronów rzutuje się do kory przedczołowej przez szlak mezokortykalny oraz mniejsza część do jądra półleżącego przez szlak mezolimbiczny. Oba te szlaki są razem nazywane rzutowaniem mezokortykolimbicznym. Odgrywają one główną rolę w układzie nagrody i innych aspektach motywacji. Pole brzuszne nakrywki wysyła także połączenia dopaminergiczne do ciała migdałowatego, zakrętu obręczy, hipokampa i opuszki węchowej.
Tylna część podwzgórza posiada neurony dopaminergiczne, które rzutują się do rdzenia kręgowego, lecz ich funkcja nie jest poznana. Istnieją przesłanki, jakoby zaburzenia w tym rejonie odgrywały istotną rolę w zespole niespokojnych nóg - chorobie w której ludzie mają problemy ze snem z powodu nieodpartej potrzeby poruszania różnymi częściami ciała, a zwłaszcza nogami.
Jądro łukowate i jądro okołokomorowe podwzgórza posiadają neurony dopaminergiczne, które tworzą szlak guzowo-lejkowy, który biegnie do przesadki i reguluje wydzielanie prolaktyny. Dopamina jest głównym inhibitorem wydzielania prolaktyny z przedniego płata przysadki mózgowej, a w przypadku jej braku prolaktyna jest wydzielana w sposób ciągły. Dopamina produkowana przez neurony w jądrze łykowatym jest wydzielana do sieci wrotnej przysadki, która ją zaopatruje odżywczo. Z powodu regulacji wydzielania prolaktyny dopamina jest nazywana także prolaktostatyną. Zaburzenia, które upośledzają wydzielanie dopaminy do przysadki jak ucisk lub uszkodzenie lejka przysadki albo stosowanie leków antydopaminergicznych takich jak np. rezerpina, meoklopramid, może doprowadzić do wystąpienia hiperprolaktynemii, czyli podwyższonego stężenia prolaktyny we krwi.
Warstwa niepewna - skupisko istoty szarej międzymózgowia i część niskowzgórza, które przybiera postać cienkiej blaszki umiejscowionej pomiędzy polem H1 Forela (tzw. pęczkiem wzgórzowym) i wzgórzem a polem Forela H2 (pęczkiem soczewkowym) i jądrem niskowzgórzowym - rzutuje się do kilku obszarów w podwzgórzu i uczestniczy w kontroli wydzielania gonadoliberyny (hormonu uwalniającego gonadotropiny, które za pośrednictwem specyficznych receptorów wpływają na strukturę i funkcję narządów docelowych, czyli gonad), która konieczna jest do rozwoju męskich i żeńskich narządów rozrodczych.
Dodatkowa grupa neuronów wydzielających dopaminę znajduje się w siatkówce oka. Są to komórki amakrynowe o krótkich wypustkach, które są szczególnie aktywne podczas dnia, zaś w nocy tracą aktywność. Dopamina w siatkówce wzmacnia aktywność czopków, natomiast zmniejsza aktywność pręcików. W rezultacie zwiększa ona wrażliwość na kolory i ostrość, gdy jest jasno kosztem zmniejszonej wrażliwości przy ograniczonym świetle.
Największym i najważniejszym źródłem dopaminy w mózgach kręgowców są istota czarna oraz pole brzuszne nakrywki. Obie struktury są blisko ze sobą związane i podobne w funkcjach. Największą strukturą jąder podstawnych jest prążkowie. Istota czarna wysyła włókna dopaminergiczne do grzbietowego prążkowia, podczas gdy pole brzuszne nakrywki wysyła je do brzusznego prążkowia. Najpopularniejsza hipoteza funkcji jąder podstawnych zakłada, iż odgrywają one główną rolę w wyborze ruchu. Onzacza to, że kiedy człowiek lub zwierzę jest w sytuacji, w której kilka różnych zachowań jest możliwych, aktywność w jądrach podstawnych determinuje, która zostanie wykonana poprzez uwolnienie jej spod działania hamującego podczas, gdy konkurencyjny ruch jest dalej hamowany.
Jądra podstawne mogą być podzielone na kilka części, spośród których każda jest zaangażowana w kontrolowanie poszczególnych typów akcji. Brzuszny sektor jąder podstawnych (zawierający brzuszne prążkowie i pole nakrywkowe brzuszne) stoi najwyżej w hierarchii wybierając działania na poziomie całego organizmu. Sektor grzbietowy z kolei (zawierający grzbietowe prążkowie i istotę czarną) - działa na niższym poziomie, wybierając konkretne mięśnie i ruchy do realizacji danych zachowań. Dopamina przyczyna się do procesu wyboru ruchu na co najmniej dwa sposoby. Ustala ona również próg dla inicjacji ruchu. Im wyższy poziom aktywności dopaminy, tym niższe wymagania do wywołania danego ruchu. Konsekwencją wysokiego poziomu dopaminyjest doprowadzenie do wysokich poziomów aktywności motorycznych i impulsywnych zachowań; niski poziom prowadzi do torporu - stanu kontrolowanego obniżenia temperatury ciała przez zwierzęta stałocieplne, gdzie wraz z obniżeniem temperatury ciała spowalniana jest praca serca, a także większości innych czynności fizjologicznych) i spowolnionych reakcji. W chorobie Parkinsona, gdy poziom dopaminy w istocie czarnej jest znacznie zmniejszony jest związany ze sztywnością i problemem z inicjacją ruchów. Mimo wszystko, kiedy ludzie z tą chorobą są wystawieni na silny bodziec taki jak np. poważne zagrożenie, ich reakcje mogą być równie energiczne co zdrowych osób. Substancje, które zwiększają uwalnianie dopaminy, takie jak np. kokaina lub amfetamina, mogą powodować pobudzenie psychoruchowe i stereotypię.
Układ nagrody, zwany również "ośrodkiem przyjemności" jest zbiorem struktur mózgowych, które są związane z motywacją i kontrolą zachowania. Ewolucyjnie, mechanizm ten został wykształcony po to, by zwiększać prawdopodobieństwo zachowań potencjalnie korzystnych dla organizmu. U naczelnych (być może także u filogenetycznie niższych zwierząt) jego pobudzenie wynika z subiektywnego odczuwania przyjemności. Układ nagrody jest aktywowany w sytuacjach zaspokajania popędów (pożywienie, zachowania seksuane), a także w trakcie wykonywania innych - już niepopędowych czynności, które oceniane są jako przyjemne. Wiele substancji psychoaktywnych takich jak alkohol, opiaty lub amfetamina, które mogą powodować uzależnienia, wiążą się z aktywacją układu nagrody. Szczury laboratoryjne, które mają możliwość elektrycznej stymulacji tego ośrodka (np. za pomocą naciśnięcia w swojej klatce) koncentrują się na tej czynności i całkowicie zaniedbują odżywianie. Sama nagroda stanowi atrakcyjną właściwość źródła bodźca nagradzającego. Bodziec nagradzający zaś to taki bodziec, który wywołuje zachowanie apetytywne (poszukujące i zmierzające do zaspokojenia danej potrzeby), a także decyzję czy należy użyć lub wykorzystać daną nagrodę. Przyjemność, nauka (warunkowanie klasyczne i instrumentalne), a także zachowanie apetytywne są trzema głównymi funkcjami nagrody. Przyjemność zawiera w sobie definicję nagrody - jednakże podczas gdy wszystkie przyjemne bodźce stanowią bodźce nagradzające, to nie wszystkie bodźce nagradzające są przyjemne (np. nagrody zewnętrzne jak pieniądze). Motywacja i pożądanie wywoływane przez bodziec nagradzający powodują zachowanie apetytywne, podczas gdy przyjemny element nagród pochodzi od zachowania konsumacyjnego, które odzwierciedla wykorzystanie nagrody. Neuropsychologiczny model, który rozróżnia te dwa składniki nagradzającego bodźca to model "przypisywania bodźcom wartości zachęcającej), gdzie "chcenie", pożądanie, poszukiwanie odpowiada zachowaniu apetetywnemu, podczas gdy lubienie lub przyjemność odpowiada zachowaniu konsumacyjnemu. U ludzi, którzy są uzależnieni "chcenie" staje się rozłączne z "lubieniem", a pragnienie zażycia uzależniającej substancji wzrasta, podczas gdy przyjemność otrzymywana z jej spożycia spada.
W mózgu dopamina pełni częściowo funkcję "ogólnego sygnału nagrody", gdzie wstępna faza odpowiedzi dopaminowej na bodziec nagradzający koduje informacje o wartości i kontekście nagrody. Dopamina pełni funkcję sygnału "przewidywania nagrody", który określa stopień w którym wartość nagrody jest neispodziewana. Nawiązując do hipotezy Wolframa Schultza - nagrody, które są spodziewane nie powodują drugiej fazy odpowiedzi dopaminowej w konkretnych neuronach dopaminergicznych. Jednakże nagrody, które są niespodziewane lub większe aniżeli oczekiwano, powodują krótkotrwały wzrost dopaminy w synapsach - natomiast utrata spodziewanej nagrody powoduje spadek uwalniania dopaminy poniżej wyjściowego poziomu.
Badania mózgów zwierząt z użyciem mikroelektrod pokazują, że neurony dopaminergiczne w polu brzusznym nakrywki i istocie czarnej są silnie aktywowane przez różne wydarzenia nagradzające. Te neurony czułe na nagrodę pełnią kluczową rolę w rozpoznaniu nagrody i służą jako główny składnik układu nagrody. Funkcja dopamny różni się w zależności od połączeń aksonalnych z pola brzusznego nakrywki (VTA) i istocie czarnej, na przykład, połączenie VTA-część zewnętrzna jądra półleżącego przypisuje bodźcom wartość zachęcającą; połączenie VTA-kora oczodołowo-czołowa aktualizuje wartości różnych celów zgodnie z nadaną im wartością; połączenie VTA - ciało migdałowate i VTA - hipokamp uczestniczy w utrwalaniu wspomnień związanych z nagrodą, zaś połączenia VTA - część wewnętrzna jądro półleżącego i istota czarna - grzbietowe prążkowe są zaangażowane w nauce odpowiedzi ruchowych ułatwiających wykorzystanie bodźców nagradzających. Niektóre aktywności połączeń VTA są także powiązane z przewidywaniem nagrody.
Dopamina pełni rolę kluczową w pożądaniu związanym z zachowaniem apetytywnym w odpowiedzi na bodziec nagradzający, jednakże nie jest w prosty sposób związana ze zjawiskiem przyjemności podczas zachowania konsumacyjnego. Przekaźnictwo dopaminy jest związane z niektórymi, lecz nie wszystkimi aspektami przyjemności, ponieważośrodki przyjemności znajdują się zarówno wukładzie dopaminowym (np. jądrze półleżącym) jak i poza nim (np. gałka blada brzuszna i jądro okołoramieniowe). Bepożsrednia elektrostymulacja szlaków dopaminergicznych za pomocą elektrod umieszczonych w mózgu jest odbierana jako przyjemna i wiele typów zwierząt wykazuje chęć do jej doświadczenia. Leki przeciwpsychotyczne używane do leczenia psychozy obniżają poziom dopaminy i wywołują często anhedonię. Wiele czynności, które są związane z przyjemnością (np. seks, jedzenie) wywołuje wzrost uwalniania dopaminy. Wszystkie substancje uzależniające w sposób pośredni lub bezpośredni wpływają na przekaźnictwo dopaminy w jądrze półleżącym i powodują wzrost pożądania substancji uzależniającej. Zwierzęta u których układ dopaminowy w polu brzusznym nakrywki został inaktywowany nie szukają jedzenia i zostawione same sobie głodują aż do śmierci, lecz jeśli jedzenie zostanie umieszczone w ich ustach - zjedzą je i wykazują ekspresję wskazującą na odczuwaną przyjemność.
Ponieważ dopamina nie przekracza bariery krew - mózg, jej synteza i funkcjonowanie w obszarach peryferyjnych są w znacznym stopniu niezależne od syntezy i działania w mózgu. Znaczna ilość dopaminy krąży we krwi, lecz jej funkcje nie są do końca poznane. Poziom dopaminy w osoczu krwi jest porównywalny do poziomu adrenaliny, lecz u ludzi ponad 95% dopaminy w osoczu jest w formie siarczanu dopaminy, połączenia tworzonego przez sulfotransferazę 1A3/A4. Znaczna część siarczanu dopaminy jest produkowana w krezce otaczającej części układu trawiennego. Jej produkcja jest uważana za mechanizm detoksykujący dopaminę spożytą z jedzenia lub wytworzoną w pocesach trawiennych - poziom w osoczu zwykle rośnie ponad pięćdziesięciokrotnie po posiłku. Siarczan dopaminy nie posiada natomiast żadnej znanej funkcji biologicznej i jest wydalany z moczem.
Małe ilości wolnej dopaminy we krwi mogą być wytworzone przez współczulny układ nerwowy, układ trawienny lub możliwie inne narządy. Może ona działać na receptory dopaminowe w tkankach peryferyjnych, być metabolizowana lub przekształcana do noradrenaliny przez enzym hydroksylazę dopaminową, który jest uwalniany do krwi przez rdzeń nadnerczy. Pewna część receptorów dopaminowych jest umiejscowiona w ścianie tętnic, gdzie działają wazodylatacyjnie (powodują rozkurcz mięśni gładkich w ścianie naczyń krwionośnych, co powoduje poszerzenie się światła naczyń oraz spadek ciśnienia krwi, a ponieważ wzrasta ogólna objętość układu krwionośnego - objętość krwi jest stała) oraz jako inhibitory wydzielania noradrenaliny. Odpowiedzi te mogą być aktywowane przez dopaminę uwalnianą z kłębka szyjnego w odpowiedzi na niski poziom tlenu. Nie wiadomo czy receptory dopaminowe w tętnicach pełnią inne funkcje biologiczne.
W układzie immunologicznym dopamina działa poprzez receptory, które są obecne na komórkach odpornościowych, a zwłaszcza na limfocytach. Dodatkowo, dopamina może być syntezowana i uwalniana w samych komórkach immunologicznych. Główny jej efekt, jaki wywiera na limfocyty polega na zmniejszeniu ich aktywności. Znaczenie tej funkcji nie jest do końca znane, lecz podejrzewa się możliwe interakcje pomiędzy układem nerwowym, a immunologicznym, co może być przyczyną niektórych chorób autoimmunologicznych.
Nerkowy układ dopaminergiczny jest zlokalizowany w komórkach nefronów w nerce, gdzie są obecne wszystkie podtypy receptorów dopaminowych. Dopamina jest syntetyzowana w komórkach kanalików i wydzielana do moczu pierwotnego. Jej działanie obejmuje zwiększenie ukrwienia nerek, zwiększając filtrację kłębuszkową i wydzielanie sodu do moczu. Stąd też upośledzenie działania tego systemu może doprowadzić do retencji sodu i rozwoju nadciśnienia. Zaburzenia wydzielania dopaminy mogą też skutkować obrzękami i powstaniem stresu oksydacyjnego. Przyczyną zaburzeń działania tego systemu mogą być czynniki genetyczne lub wysokie ciśnienie krwi.
W trzustce, jej egzokrynowa część wydziela do dwunastnicy enzymy trawienne, a także inne substancje, m.in. właśnie dopaminę. Dopuszcza się, że jej funkcja polega na ochronie błony śluzowej jelit od uszkodzeń, a także na zmniejszeniu motoryki przewodu pokarmowego. Wyspy trzustkowe stanowią endokrynową część trzustki, które syntetyzują i wydzielają hormony do krwiobiegu. Komórki beta w wyspach syntezujące insulinę zawierają receptory dopaminowe, których aktywacja zmniejsza ilość wydzielanej insuliny. Źródło dopaminy w trzustce nie jest znane - może ono pochodzić z przepływającej krwi, lecz istnieje również możliwość syntezy miejscowej przez inne typy komórek trzustki.
Istotna jest rola dopaminy w Chorobie Parkinsona. Choroba Parkinsona jest zaburzeniem, które charakteryzuje się m.in. sztywnością mięśni, spowolnieniem ruchów, a także drżeniem kończyn w stanie spoczynku. W późniejszym stadium prowadzi do demencji i ewentualnej śmierci. Główne objawy są powiązane z niedoborem dopaminy. Przyczyną jej braku jest obumarcie komórek ją wydzielających w istocie czarnej śródmózgowia. Są one szczególnie podatne na uszkodzenia. Czynnika ich zniszczenia mogą być częste wstrząśnienia mózgu; zapalenie mózgu lub też zatrucia niektórymi substancjami. Prowadzi to do parkinsonizmu, czyli zespołu objawów choroby Parkinsona. Mimo wszystko w większości przypadków choroby Parkinsona mamy do czynienia z niejasną przyczyną śmierci komórek.
Najbardziej powszechnym leczeniem parkinsonizmu jest podawanie lewodopy, która stanowi metaboliczny prekursor dopaminy. Nie powoduje to odzyskania utraconych komórek, ale pobudza pozostałe komórki do produkcji większej ilości dopaminy, dzięki czemu rekompensuje to ich ubytek. W zaawansowanym stadium rozwoju choroby leczenie przestaje działać, ponieważ utrata komórek jest na tyle duża, że pozostałe komórki nie nadążają z produkcją dopaminy pomimo podawania lewodopy. Na tym etapie mechanizmy regulujące metabolizm w tych komórkach pracując ponad normę stają się neregularne prowadząc do zespołu dysregulacji dopaminowej, który powoduje naprzemienne stany hiperaktywności i paraliżu.
Dopamina odgrywa także istotną rolę w przetwarzaniu bólu na wielu poziomach ośrodkowego układu nerwowego, do których zalicza się rdzeń kręgowy, istota szara okołowodociągowa, wzgórze, jądra podstawne i zakręt obręczy. Anomalie w neurotransmisji dopaminy wykazane zostały w bolesnych chorobach takich jak np. fibromialgia, która stanowi zespół choroby, dla którego charakterystyczny jest uogólniony ból w układzie ruchu z występowaniem charakterystycznych punktów, rozmieszczonych symetrycznie (tzw. punktów spustowych), które są wrażliwe na ucisk, któremu towarzyszy uczucie przewlekłego zmęczenia i wrażenie sztywności, a także sen, który nie powoduje poczucia odpoczynku. Inne choroby związane z nieprawidłowościami w neurotransmisji dopaminy są zespół niespokojnych nóg i zespół piekących ust. Przeciwbólowe właściwości dopaminy są zaś wynikiem aktywacji receptora dopaminowego D2. Wyjątkiem od tego jest istota szara okołowodociągowa, w której aktywacja receptora dopaminowego D1 osłabia ból prawdopodobnie poprzez aktywację neuronów, które odpowiedzialne są za inhibicję przekazywania impulsów bólu.
Anormalnie wysoka neurotransmisja dopaminy jest z kolei powiązana z psychozą i schizofrenią. Warto jednakże wspomnieć o tym, iż badania wiążące schizofrenię z metabolizmem dopaminy w mózgu wahały się od kontrowersyjnych do negatywnych ze względu na ten sam poziom kwasu homowanilinowego (stanowiącego metabolit dopaminy) w płynie mózgowo-rdzeniowym zarówno u schizofreników jak i grupy kontrolnej. U niektórych schizofreników odkryta została zwiększona aktywność układu dopaminergicznego, a zwłaszcza szlaku mezolimbicznego, zaś u niektórych zmniejszona szlaku mezokortykalnego. Podejrzewa się, że te dwa szlaki są odpowiedzialne za różne typy schizofrenii.
Leki przeciwpsychotyczne, zwane również neuroleptykami są zwykle antagonistami receptorów dopaminowych, zmniejszając ilość dopaminy w receptorach, a przez to znosząc efekty jej wysokiej ilości. Leki przeciwpsychotyczne pierwszej generacji działają zazwyczaj na receptory D2, podczas gdy leki drugiej generacji działają także na receptory D1, D3, D4, chociaż ogólnie mają niższe powinowactwo do receptorów dopaminowych. Kokaina, amfetamina, metamfetamina i podobne substancje, które zwiększają poziom dopaminy ponad dziesięciokrotnie, mogą chwilowo spowodować psychozę, co wspiera jej związek z dopaminą - aczkolwiek wiele substancji niewpływających na poziom dopaminy również może wywołać ostrą i chroniczną psychozę. Istnieje teoria, iż schizofrenia może mieć związek także z nieprawidłową budową receptora D2 u chorych z tejże grupy.
Dysregulacja układu dopaminergicznego jest również powiązana z zaburzeniami depresyjnymi. U osób z depresją badania wykazały bowiem zmniejszoną ilość tyrozyny - prekursoru dopaminy w osoczu krwi i płynie mózgowo - rdzeniowym. W innych badaniach u osób z depresją odkryto zmniejszoną ilość kwasu homowanilinowego, który jest głównym metabolitem dopaminy w płynie mózgowo - rdzeniowym. Wykazano ponadto, że wiele leków przeciwdepresyjnych zwiększa stężenie dopaminy w korze przedczołowej u szczurów. Podobnie terapia elektrowstrząsowa zwiększyła poziom dopaminy w prążkowiu u badanych szczurów. Wykazano niski potencjał przyłączania się dopaminy do receptorów D2 u osób cierpiących na fobię społeczną. Uczeni spekulują na temat prawdopodobnej patologicznie niższej aktywności układu dopaminergicznego w stosunku do aktywności układu współczulnego u ludzi będących socjofobami.
Ponadto jedną z przyczyn zespołu Tourette'a jest zaburzenie dozowania ilości dopaminy.
 Serotonina - serotonina zwana w mowie potocznej "hormonem szczęścia" jest 5-hydroksylową pochodną tryptaminy - aminy biogennej, która powszechnie występuje w organizmach żywych. In vivo jest ona syntetyzowana z tryptofanu, jako etap pośredni wytwarzania indolu i wielu innych alkaloidów. Najbardziej znanymi tryptaminami naturalnymi są właśnie serotonina i melatonina. Tryptaminy są również powszechne w roślinach, zwierzętach, a także w mózgu ludzkich. Z opisów osobistych doświadczeń i eksperymentów (przeprowadzanych na sobie) zasłynął Alexander Shulgin o pseudonimie "Sasha" - ten amerykański chemik i farmakolog rosyjskiego pochodzenia, był wynalazcą leków i działaczem na rzecz legalizacji wybranych substancji . Wraz ze swą żoną - Ann Shulgin, napisał dwie książki - "PiHKAL" i "TiHKAL". Z kolei Tryptofan - prekursor Tryptaminy - jest aminokwasem białkowym obojętnym elektrycznie, który wchodzi w skład m.in. białka mleka i krwi. Należy on do aminokwasów niezbędnych, zatem nie może być on syntezowany w organizmie człowieka i musi być dostarczany do organizmu wraz z pożywieniem (aminokwas egzogenny). W ORGANIZMIE ZACHODZI NASTĘPUJĄCA PRZEMIANA:
Serotonina - serotonina zwana w mowie potocznej "hormonem szczęścia" jest 5-hydroksylową pochodną tryptaminy - aminy biogennej, która powszechnie występuje w organizmach żywych. In vivo jest ona syntetyzowana z tryptofanu, jako etap pośredni wytwarzania indolu i wielu innych alkaloidów. Najbardziej znanymi tryptaminami naturalnymi są właśnie serotonina i melatonina. Tryptaminy są również powszechne w roślinach, zwierzętach, a także w mózgu ludzkich. Z opisów osobistych doświadczeń i eksperymentów (przeprowadzanych na sobie) zasłynął Alexander Shulgin o pseudonimie "Sasha" - ten amerykański chemik i farmakolog rosyjskiego pochodzenia, był wynalazcą leków i działaczem na rzecz legalizacji wybranych substancji . Wraz ze swą żoną - Ann Shulgin, napisał dwie książki - "PiHKAL" i "TiHKAL". Z kolei Tryptofan - prekursor Tryptaminy - jest aminokwasem białkowym obojętnym elektrycznie, który wchodzi w skład m.in. białka mleka i krwi. Należy on do aminokwasów niezbędnych, zatem nie może być on syntezowany w organizmie człowieka i musi być dostarczany do organizmu wraz z pożywieniem (aminokwas egzogenny). W ORGANIZMIE ZACHODZI NASTĘPUJĄCA PRZEMIANA:
L-Tryptofan (Trp) ---> 5-hydroksytryptofan ---> serotonina
Przemianę tę możemy podzielić na dwa etapy:
1. Addycja grupy hydroksylowej do tryptofanu w obecności hydroksylazy tryptofanowej, dzięki czemu powstaje 5-hydroksytryptofan.
2. Dekarboksylacja powstałego 5-hydroksytryptofanu przeprowadzana przez dekarboksylazę 5-hydroksytryptofanu.
Przemiany tryptofanu prowadzą również do otrzymania melatoniny, niacyny i roślinnych hormonów wzrostu (auksyn).
Serotonina jest hormonem tkankowym (hormonem zwierzęcym, który uczestniczy w lokalnym pozanerwowym sterowaniu działaniem narządów), a także ważnym neuroprzekaźnikiem w ośrodkowym układzie nerwowym. Produkowana jest głównie w komórkach enterochromatofilnych w błonie śluzowej jelit (około 90% serotoniny przewodu pokarmowego) i jądrach szwu w mózgu, a także w szyszynce i trombocytach. Spożywanie czekolady pobudza jej syntezę. Najwyższy poziom serotoniny występuje u noworodków, później okresowo spada podczas dojrzewania, po czym ponownie wzrasta. U mężczyzn jest średnio o 20-30% niższy niż u kobiet. Serotonina występuje również w niektórych roślinach, np. pokrzywie, bananie, itd.
Współdziałając z melatoniną serotonina reguluje sen. Blokowanie jej syntezy powoduje bezsenność. Ponadto reguluje ona apetyt (hamuje go po spożyciu węglowodanów, zaś podwyższa po spożyciu białek), a także temperaturę ciała, ciśnienie krwi (które podwyższa) i jej krzepnięcie. Powoduje również skurcz mięśni gładkich (naczyń krwionośnych, oskrzeli, macicy, jelit). Ilość serotoniny w mózgu wpływa również na potrzeby seksualne i zachowania impulsywne. Niski poziom serotoniny powodować może agresywność oraz zmęczenie, a także zwiększoną wrażliwość na ból i zaburzenia depresyjne. Mutacje w genie kodującym receptor 5-HT2A mogą zwiększać ryzyko popełnienia samobójstwa dwukrotnie u osób z takim genotypem.
Receptor 5-HT2A to transbłonowe białko, które jest kodowane u człowieka genem HTR2A w chromosomie 13, locus 13q14-q21, należące do rodziny receptorów serotoninowych. Jest on głównym pobudzającym receptorem sprzężonym z białkami G dla serotoniny. Receptor ten występuje w wielu strukturach ośrodkowego układu nerwowego, m.in. w korze nowej (głównie przedczołowej, ciemieniowej i somatosensorycznej), a także guzkach węchowych. Ich najgęstsze rozmieszczenie obecne jest w dendrytach końcowych neuronów piramidowych V warstwy kory mózgowej i może mieć związek z modulacją procesów poznawczych, za pośrednictwem glutaminianu i szeregu receptorów. Występuje również w dużych ilościach w płytkach krwi.
Aktywacja tego receptora jest głównym mechanizmem działania psychodelików takich jak LSD, psylocyna lub meskalina. Antagonizm wobec 5-HT2A jest obok antagonizmu D2 jednym z mechanizmów działania atypowych leków przeciwpsychotycznych. Regulacja w dół i odwrażliwienie postsynaptycznych receptorów 5-HT2A towarzyszy przyjmowaniu leków przeciwdepresyjnych z grupy selektywnych inhibitorów wychwytu zwrotnego serotoniny (SSRI).
Źródła:
- Ben Best - Brain Neurotransmitters: http://www.benbest.com/science/anatmind/anatmd10.html,
- - The Neurotransmitter Collection - The Florida State University - Molecular Expressions: https://micro.magnet.fsu.edu/micro/gallery/neurotrans/neurotrans.html
- - Wikipedia (PL) i (EN),
- - Neuropsychologia.org,
- - "Biochemia - Krótki kurs" - J.L. Tymoczko; J.M. Berg;l L. Stryer,
- - "Zarys biochemii" - Peter Karlson,
- - Władysław Zygmunt Traczyk, Andrzej Trzebski, Fizjologia człowieka z elementami fizjologii stosowanej i klinicznej, 2009.
- - Farmakopea Polska X, Polskie Towarzystwo Farmaceutyczne, Warszawa: Urząd Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych, 2014, s. 4276, ISBN 978-83-63724-47-4.
- - Towarzystwo Farmaceutyczne: "Farmakopea Polska IX - Warszawa: Urząd Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych, 2011, s. 4574,
- - Zaawansowane zabiegi resuscytacyjne – algorytm postępowania w tachykardii, Polska Rada Resuscytacji za European Resuscitation Council, 2010 [dostęp 2012-12-16].
- - Joseph D. Losek i inni, Adenosine and Pediatric Supraventricular Tachycardia in the Emergency Department: Multicenter Study and Review, „Annals of Emergency Medicine”, 33 (2), s. 185–191, DOI: 10.1016/s0196-0644(99)70392-6, PMID: 9922414
- - Baza PubChem, United States National Library of Medicine - opisy poszczególnych neuroprzekaźników,
- - Informacje o substancjach aktywnych - DrugBank,
- - Wielka encyklopedia zdrowia. Wojciech Twardosz (red.) T. I: Ab-Az Poznań: Wydawnictwo HORYZONT, 2002 - s. 12-13ISBN 83-89242-01-X.
- - Mała encyklopedia medycyny. Wyd. IV. T. I: A–G. Warszawa: PWN, 1988, s. 11. ISBN 83-01-08835-4.
- -Szymonowicz W, Cybulski N: O funkcji nadnercza. 1895.
- - Katedra Historii Medycyny CM UJ - Fizjologia,
- - Bolesława Arabska-Przedpełska, Halina Pawlicka: Współczesna endodoncja w praktyce. Łódź. Bestom DENTOnet.pl , 2011, s. 133. ISBN 978-83-927915-6-0.
- - Anandamid (nr A0580) (ang.) – karta charakterystyki produktu Sigma-Aldrich (Merck KGaA) na obszar Stanów Zjednoczonych (ze względu na zmianę sposobu wywołania karty charakterystyki, aby pobrać kartę dla obszaru USA, na stronie produktu należy zmienić lokalizację na "United States" i ponownie pobrać kartę). [dostęp 2012-02-13].
- - P.B. Sparling i inni, Exercise activates the endocannabinoid system, „NeuroReport”, 14 (17), 2003, s. 2209-2211 [dostęp 2017-07-25] (ang.).
- - David Terraso: Research Locates Source of Runner's High Experienced by Athletes (ang.). Georgia Institute of Technology, 2004-01-08. [dostęp 2017-07-25].
- Devane i inni, Isolation and structure of a brain constituent that binds to the cannabinoid receptor, „Science”, 258, 1992, s. 1946–1949, DOI: 10.1126/science.1470919, PMID: 1470919.
- R. Mechoulam, E. Fride: The unpaved road to the endogenous brain cannabinoid ligands, the anandamides. W: Cannabinoid Receptors. R. Pertwee (red.). London: Academic Press, 1995, s. 233–258. ISBN 978-0125514606.
- Stella, N., Schweitzer, P., Piomelli, D. A second endogenous cannabinoid that modulates long-term potentiation. Nature 388 773-778 (1997).
- Sugiura, T., Kodaka, T., Nakane, S., et al. Evidence that the cannabinoid CB1 receptor is a 2-arachidonoylglycerol receptor. Structure-activity relationship of 2-arachidonoylglycerol, ether-linked analogues, and related compounds. J Biol Chem 274 2794-2801 (1999).
- Dopamina (nr H8502) – karta charakterystyki produktu Sigma-Aldrich (Merck KGaA) na obszar Polski.
- ↑ a b Dopamina (CID: 681) (ang.) w bazie PubChem, United States National Library of Medicine.
- ↑ a b c d Dopamina (DB00988) – informacje o substancji aktywnej (ang.). DrugBank.
- ↑ Dopamina (ang.) w bazie ChemIDplus, United States National Library of Medicine. [dostęp 2012-08-03].
- ↑ a b Wojciech Kostowski, Zbigniew S. Herman: Farmakologia – podstawy farmakoterapii: podręcznik dla studentów medycyny i lekarzy. Wyd. 3 poprawione i uzupełnione. Warszawa: Wydawnictwo Lekarskie PZWL, 2006, s. 1569. ISBN 83-200-3352-7.
- ↑ Dopamine (ang.). PubChem.
- ↑ Catecholamine (ang.). Brittanica.
- ↑ Phenylethylamine (ang.). ChemicalLand21.com.
- ↑ a b c d e f g Dopamine Hydrochloride. „Analytical Profiles of Drug Substances”. 11, s. 257–272, 1982 (ang.).
- ↑ a b c d e f Chapter 1: Historical overview: Introduction to the dopamine receptors. W: The Dopamine Receptors. Springer, 2009, s. 1–22. ISBN 1-60327-333-6. (ang.)
- ↑ a b c d e f g h Chapter 1: Enzymes involved in the biosynthesis and degradation of catecholamines. W: Biochemistry of Biogenic Amines. Springer, 2013, s. 1–35. ISBN 1-4684-3171-4. (ang.)
- ↑ a b c Symptomatic pharmacological therapy in Parkinson’s disease. W: Parkinson's Disease. London: Royal College of Physicians, 2006, s. 59–100. ISBN 1-86016-283-5. (ang.)
- Graeme Eisenhofer, Irwin J. Kopin, David S. Goldstein, Catecholamine metabolism: a contemporary view with implications for physiology and medicine, „Pharmacological Reviews”, 56 (3), 2004, s. 331–349, DOI: 10.1124/pr.56.3.1, PMID: 15317907 (ang.).
- F. Amin, M. Davidson, K.L. Davis, Homovanillic acid measurement in clinical research: a review of methodology, „Schizophrenia Bulletin”, 18 (1), 1992, s. 123–148, DOI: 10.1093/schbul/18.1.123, PMID: 1553492 (ang.).
- F. Amin i inni, Assessment of the Central Dopaminergic Index of Plasma HVA in Schizophrenia, „Schizophrenia Bulletin”, 21 (1), 1995, s. 53–66, DOI: 10.1093/schbul/21.1.53, PMID: 7770741 (ang.).
- Intraneuronal dopamine-quinone synthesis: a review. „Neurotoxicity Research”. 1 (3), s. 181–95, 2000. DOI: 10.1007/BF03033289. PMID: 12835101 (ang.).
- Ikuko Miyazaki, Masato Asanuma, Dopaminergic neuron-specific oxidative stress caused by dopamine itself, „Acta Medica Okayama”, 62 (3), 2008, s. 141–150, DOI: 10.18926/AMO/30942, PMID: 18596830 (ang.).
- Dopamine: Biological activity (ang.). International Union of Basic and Clinical Pharmacology.
- David K. Grandy, Gregory M. Miller, Jun-Xu Li, "TAARgeting Addiction"--The Alamo Bears Witness to Another Revolution: An Overview of the Plenary Symposium of the 2015 Behavior, Biology and Chemistry Conference, „Drug and Alcohol Dependence”, 159, 2016, s. 9–16, DOI: 10.1016/j.drugalcdep.2015.11.014, PMID: 26644139, PMCID: PMC4724540 (ang.).
- Chapter 6: Dopamine receptor signalling: intracellular pathways to behavior. W: The Dopamine Receptors. Springer, 2009, s. 137–174. ISBN 1-60327-333-6. (ang.)
- Lee E. Eiden i inni, The vesicular amine transporter family (SLC18): amine/proton antiporters required for vesicular accumulation and regulated exocytotic secretion of monoamines and acetylcholine, „Pflugers Archiv: European Journal of Physiology”, 447 (5), 2004, s. 636–640, DOI: 10.1007/s00424-003-1100-5, PMID: 12827358 (ang.).
- David K. Grandy, Gregory M. Miller, Jun-Xu Li, "TAARgeting Addiction"--The Alamo Bears Witness to Another Revolution: An Overview of the Plenary Symposium of the 2015 Behavior, Biology and Chemistry Conference, „Drug and Alcohol Dependence”, 159, 2016, s. 9–16, DOI: 10.1016/j.drugalcdep.2015.11.014, PMID: 26644139, PMCID: PMC4724540 (ang.).
- Gregory M. Miller, The emerging role of trace amine-associated receptor 1 in the functional regulation of monoamine transporters and dopaminergic activity, „Journal of Neurochemistry”, 116 (2), 2011, s. 164–176, DOI: 10.1111/j.1471-4159.2010.07109.x, PMID: 21073468, PMCID: PMC3005101 (ang.).
- Jean-Martin Beaulieu, Raul R. Gainetdinov, The physiology, signaling, and pharmacology of dopamine receptors, „Pharmacological Reviews”, 63 (1), 2011, s. 182–217, DOI: 10.1124/pr.110.002642, PMID: 21303898 (ang.).
- Gonzalo E. Torres, Raul R. Gainetdinov, Marc G. Caron, Plasma membrane monoamine transporters: structure, regulation and function, „Nature Reviews. Neuroscience”, 4 (1), 2003, s. 13–25, DOI: 10.1038/nrn1008, PMID: 12511858 (ang.).
- M.E. Rice, J.C. Patel, S.J. Cragg, Dopamine release in the basal ganglia, „Neuroscience”, 198, 2011, s. 112–137, DOI: 10.1016/j.neuroscience.2011.08.066, PMID: 21939738, PMCID: PMC3357127 (ang.).
- Wolfram Schultz, Multiple dopamine functions at different time courses, „Annual Review of Neuroscience”, 30, 2007, s. 259–288, DOI: 10.1146/annurev.neuro.28.061604.135722, PMID: 17600522 (ang.).
- Anders Björklund, Stephen B. Dunnett, Dopamine neuron systems in the brain: an update, „Trends in Neurosciences”, 30 (5), 2007, s. 194–202, DOI: 10.1016/j.tins.2007.03.006, PMID: 17408759 (ang.).
- A. Dahlström, K. Fuxe. Evidence for the existence of monoamine-containing neurons in the central nervous system. I. Demonstration of monoamines in the cell bodies of brain stem neurons. „Acta Physiologica Scandinavica”. 62 (Suppl. 232), s. 1–55, 1964. PMID: 14229500 (ang.).
- Chapter 6: Widely Projecting Systems: Monoamines, Acetylcholine, and Orexin. W: Molecular Neuropharmacology: A Foundation for Clinical Neuroscience. Wyd. 2nd. New York: McGraw-Hill Medical, 2009, s. 147–148, 154–157. ISBN 0-07-148127-3.(ang.)
- Chadwick W. Christine, Michael J. Aminoff, Clinical differentiation of parkinsonian syndromes: prognostic and therapeutic relevance, „The American Journal of Medicine”, 117 (6), 2004, s. 412–419, DOI: 10.1016/j.amjmed.2004.03.032, PMID: 15380498 (ang.).
- Dopamine and the spinal cord in restless legs syndrome: does spinal cord physiology reveal a basis for augmentation?. „Sleep Medicine Reviews”. 10 (3), s. 185–96, 2006. DOI: 10.1016/j.smrv.2006.01.004. PMID: 16762808 (ang.).
- N. Ben-Jonathan, R. Hnasko, Dopamine as a prolactin (PRL) inhibitor, „Endocrine Reviews”, 22 (6), 2001, s. 724–763, DOI: 10.1210/edrv.22.6.0451, PMID: 11739329 (ang.).
- Paul Witkovsky, Dopamine and retinal function, „Documenta Ophthalmologica. Advances in Ophthalmology”, 108 (1), 2004, s. 17–40, DOI: 10.1023/B:DOOP.0000019487.88486.0a, PMID: 15104164 (ang.).
- Basal Ganglia and the Striatal Motor System. W: Neuroanatomy (Board Review Series). Wyd. 4th. Baltimore: Wulters Kluwer & Lippincott Wiliams & Wilkins, 2008, s. 274–281. ISBN 0-7817-7245-1. (ang.)
- V.S. Chakravarthy, Denny Joseph, Raju S. Bapi, What do the basal ganglia do? A modeling perspective, „Biological Cybernetics”, 103 (3), 2010, s. 237–253, DOI: 10.1007/s00422-010-0401-y, PMID: 20644953 (ang.).
- W ten sposób jądra podstawne są odpowiedzialne za rozpoczęcie ruchu, ale nie determinują w szczegółach jak zostanie on wykonanyStan B. Floresco, The nucleus accumbens: an interface between cognition, emotion, and action, „Annual Review of Psychology”, 66, 2015, s. 25–52, DOI: 10.1146/annurev-psych-010213-115159, PMID: 25251489 (ang.).Skocz do:Bernard W Balleine i inni, Hierarchical control of goal-directed action in the cortical–basal ganglia network, „Current Opinion in Behavioral Sciences”, 5, 2015, s. 1–7, DOI: 10.1016/j.cobeha.2015.06.001 (ang.).
- Jankovic, Parkinson's disease: clinical features and diagnosis, „Journal of Neurology, Neurosurgery, and Psychiatry”, 79 (4), 2008, s. 368–376, DOI: 10.1136/jnnp.2007.131045, PMID: 18344392 (ang.).
- Tommy Pattij, Louk J.M.J. Vanderschuren, The neuropharmacology of impulsive behaviour, „Trends in Pharmacological Sciences”, 29 (4), 2008, s. 192–199, DOI: 10.1016/j.tips.2008.01.002, PMID: 18304658.
- Wolfram Schultz, Neuronal Reward and Decision Signals: From Theories to Data, „Physiological Reviews”, 95 (3), 2015, s. 853–951, DOI: 10.1152/physrev.00023.2014, PMID: 26109341, PMCID: PMC4491543, Cytat: Rewards are crucial objects that induce learning, approach behavior, choices, and emotions. Whereas emotions are difficult to investigate in animals, the learning function is mediated by neuronal reward prediction error signals which implement basic constructs of reinforcement learning theory. These signals are found in dopamine neurons, which emit a global reward signal to striatum and frontal cortex, and in specific neurons in triatum, amygdala, and frontal cortex projecting to select neuronal populations ... FIGURE 12. Reward components inducing the two phasic dopamine response components. The initial component (blue) detects the event before having identified its value. It increases with sensory impact (physical salience), novelty (novelty/surprise salience), generalization to rewarded stimuli, and reward context. This component is coded as temporal event prediction error (389). The second component (red) codes reward value (as reward prediction error) ... The salience of rewards derives from three principal factors, namely, their physical intensity and impact (physical salience), their novelty and surprise (novelty/surprise salience), and their general motivational impact shared with punishers (motivational salience). A separate form not included in this scheme, incentive salience, primarily addresses dopamine function in addiction and refers only to approach behavior (as opposed to learning) (ang.).
- T.E. Robinson, K.C. Berridge, The neural basis of drug craving: an incentive-sensitization theory of addiction, „Brain Research. Brain Research Reviews”, 18 (3), 1993, s. 247–291, DOI: 10.1016/0165-0173(93)90013-p, PMID: 8401595 (ang.).
- Jason S. Wright, Jaak Panksepp, An Evolutionary Framework to Understand Foraging, Wanting, and Desire: The Neuropsychology of the SEEKING System, „Neuropsychoanalysis”, 14 (1), 2012, s. 5–39, DOI: 10.1080/15294145.2012.10773683 (ang.).
- Molecular Neuropharmacology: A Foundation for Clinical Neuroscience. Wyd. 2nd. New York: McGraw-Hill Medical, 2009, s. 147–148, 366–367, 375–376. ISBN 978-0-07-148127-4. Cytat: VTA DA neurons play a critical role in motivation, reward-related behavior (Chapter 15), attention, and multiple forms of memory. This organization of the DA system, wide projection from a limited number of cell bodies, permits coordinated responses to potent new rewards. Thus, acting in diverse terminal fields, dopamine confers motivational salience (“wanting”) on the reward itself or associated cues (nucleus accumbens shell region), updates the value placed on different goals in light of this new experience (orbital prefrontal cortex), helps consolidate multiple forms of memory (amygdala and hippocampus), and encodes new motor programs that will facilitate obtaining this reward in the future (nucleus accumbens core region and dorsal striatum). In this example, dopamine modulates the processing of sensorimotor information in diverse neural circuits to maximize the ability of the organism to obtain future rewards. ...
The brain reward circuitry that is targeted by addictive drugs normally mediates the pleasure and strengthening of behaviors associated with natural reinforcers, such as food, water, and sexual contact. Dopamine neurons in the VTA are activated by food and water, and dopamine release in the NAc is stimulated by the presence of natural reinforcers, such as food, water, or a sexual partner. ...
The NAc and VTA are central components of the circuitry underlying reward and memory of reward. As previously mentioned, the activity of dopaminergic neurons in the VTA appears to be linked to reward prediction. The NAc is involved in learning associated with reinforcement and the modulation of motoric responses to stimuli that satisfy internal homeostatic needs. The shell of the NAc appears to be particularly important to initial drug actions within reward circuitry; addictive drugs appear to have a greater effect on dopamine release in the shell than in the core of the NAc. ... If motivational drive is described in terms of wanting, and hedonic evaluation in terms of liking, it appears that wanting can be dissociated from liking and that dopamine may influence these phenomena differently. Differences between wanting and liking are confirmed in reports by human addicts, who state that their desire for drugs (wanting) increases with continued use even when pleasure (liking) decreases because of tolerance.. (ang.) - Kent C. Berridge, Terry E. Robinson, J. Wayne Aldridge, Dissecting components of reward: 'liking', 'wanting', and learning, „Current Opinion in Pharmacology”, 9 (1), 2009, s. 65–73, DOI: 10.1016/j.coph.2008.12.014, PMID: 19162544, PMCID: PMC2756052, Cytat: Conversely, amplification of ‘wanting’ without ‘liking’ has been produced by the activation of dopamine systems by amphetamine or similar catecholamine-activating drugs given systemically or microinjected directly into the nucleus accumbens, or by genetic mutation that raises extracellular levels of dopamine (via knockdown of dopamine transporters in the synapse) in mesocorticolimbic circuits, and by the near-permanent sensitization of mesocorticolimbic-dopamine-related systems by repeated administration of high-doses of addictive drugs (Figure 3–Figure 5) [39•,40•,61•,66]. We have proposed that in susceptible individuals the neural sensitization of incentive salience by drugs of abuse may generate compulsive ‘wanting’ to take more drugs, whether or not the same drugs are correspondingly ‘liked’, and thus contribute to addiction [39•,40•,42] (Figure 5).(ang.).
- Ethan S. Bromberg-Martin, Masayuki Matsumoto, Okihide Hikosaka, Dopamine in motivational control: rewarding, aversive, and alerting, „Neuron”, 68 (5), 2010, s. 815–834, DOI: 10.1016/j.neuron.2010.11.022, PMID: 21144997, PMCID: PMC3032992(ang.).
- L.M. Yager i inni, The ins and outs of the striatum: role in drug addiction, „Neuroscience”, 301, 2015, s. 529–541, DOI: 10.1016/j.neuroscience.2015.06.033, PMID: 26116518, PMCID: PMC4523218 (ang.).
- Michael P. Saddoris i inni, Differential Dopamine Release Dynamics in the Nucleus Accumbens Core and Shell Reveal Complementary Signals for Error Prediction and Incentive Motivation, „The Journal of Neuroscience: The Official Journal of the Society for Neuroscience”, 35 (33), 2015, s. 11572–11582, DOI: 10.1523/JNEUROSCI.2344-15.2015, PMID: 26290234, PMCID: PMC4540796, Cytat: Here, we have found that real-time dopamine release within the nucleus accumbens (a primary target of midbrain dopamine neurons) strikingly varies between core and shell subregions. In the core, dopamine dynamics are consistent with learning-based theories (such as reward prediction error) whereas in the shell, dopamine is consistent with motivation-based theories (e.g., incentive salience). (ang.).
- Kent C. Berridge, Morten L. Kringelbach, Pleasure systems in the brain, „Neuron”, 86 (3), 2015, s. 646–664, DOI: 10.1016/j.neuron.2015.02.018, PMID: 25950633, PMCID: PMC4425246 (ang.).
- Roy A. Wise, Dopamine and reward: the anhedonia hypothesis 30 years on, „Neurotoxicity Research”, 14 (2-3), 2008, s. 169–183, DOI: 10.1007/BF03033808, PMID: 19073424, PMCID: PMC3155128 (ang.).
- Oscar Arias-Carrión, Ernst Pŏppel, Dopamine, learning, and reward-seeking behavior, „Acta Neurobiologiae Experimentalis”, 67 (4), 2007, s. 481–488, PMID: 18320725 (ang.).
- J.D. Salamone i inni, Nucleus accumbens dopamine and the regulation of effort in food-seeking behavior: implications for studies of natural motivation, psychiatry, and drug abuse, „The Journal of Pharmacology and Experimental Therapeutics”, 305 (1), 2003, s. 1–8, DOI: 10.1124/jpet.102.035063, PMID: 12649346 (ang.).
- Chandrani Sarkar i inni, The immunoregulatory role of dopamine: an update, „Brain, Behavior, and Immunity”, 24 (4), 2010, s. 525–528, DOI: 10.1016/j.bbi.2009.10.015, PMID: 19896530, PMCID: PMC2856781 (ang.).
- Tahir Hussain, Mustafa F. Lokhandwala, Renal dopamine receptors and hypertension, „Experimental Biology and Medicine”, 228 (2), 2003, s. 134–142, DOI: 10.1177/153537020322800202, PMID: 12563019 (ang.).
- Marcelo Roberto Choi i inni, Renal dopaminergic system: Pathophysiological implications and clinical perspectives, „World Journal of Nephrology”, 4 (2), 2015, s. 196–212, DOI: 10.5527/wjn.v4.i2.196, PMID: 25949933, PMCID: PMC4419129 (ang.).
- R.M. Carey, Theodore Cooper Lecture: Renal dopamine system: paracrine regulator of sodium homeostasis and blood pressure, „Hypertension”, 38 (3), 2001, s. 297–302, DOI: 10.1161/hy0901.096422, PMID: 11566894 (ang.).
- Blanca Rubí, Pierre Maechler, Minireview: new roles for peripheral dopamine on metabolic control and tumor growth: let's seek the balance, „Endocrinology”, 151 (12), 2010, s. 5570–5581, DOI: 10.1210/en.2010-0745, PMID: 21047943 (ang.).
- Merims D, Giladi N. Dopamine dysregulation syndrome, addiction and behavioral changes in Parkinson's disease. „Parkinsonism & Related Disorders”. 14 (4), s. 273-280, 2008. DOI: 10.1016/j.parkreldis.2007.09.007. PMID: 17988927.
- Jing Wu i inni, Role of dopamine receptors in ADHD: a systematic meta-analysis, „Molecular Neurobiology”, 45 (3), 2012, s. 605–620, DOI: 10.1007/s12035-012-8278-5, PMID: 22610946.
- Craig W. Berridge, David M. Devilbiss, Psychostimulants as cognitive enhancers: the prefrontal cortex, catecholamines, and attention-deficit/hyperactivity disorder, „Biological Psychiatry”, 69 (12), 2011, e101–111, DOI: 10.1016/j.biopsych.2010.06.023, PMID: 20875636, PMCID: PMC3012746.
- S.K. Jääskeläinen i inni, Role of the dopaminergic system in chronic pain - a fluorodopa-PET study, „Pain”, 90 (3), 2001, s. 257–260, DOI: 10.1016/S0304-3959(00)00409-7, PMID: 11207397.
- Patrick B. Wood, Role of central dopamine in pain and analgesia, „Expert Review of Neurotherapeutics”, 8 (5), 2008, s. 781–797, DOI: 10.1586/14737175.8.5.781, PMID: 18457535.
- Disruption of gene interaction linked to schizophrenia (ang.). St. Jude Children's Research Hospital. [dostęp 2006-07-06].
- J.W. Maas i inni, Schizophrenia, Psychosis, and Cerebral Spinal Fluid Homovanillic Acid Concentrations, „Schizophrenia Bulletin”, 23 (1), 1997, s. 147–154, DOI: 10.1093/schbul/23.1.147, PMID: 9050120 (ang.).
- Dopamine Receptor Blockade: Antipsychotic Drugs, www.williams.edu [dostęp 2017-11-22].
- Dopamine and antipsychotic drug action revisited | The British Journal of Psychiatry, bjp.rcpsych.org [dostęp 2017-11-22] (ang.).
- M.J. Durcan i inni, Is clozapine selective for the dopamine D4 receptor?, „Life Sciences”, 57 (18), 1995, PL275–283, DOI: 10.1016/0024-3205(95)02151-8, PMID: 7475902 (ang.).
- Methamphetamine 101
- J.A. Lieberman, J.M. Kane, J. Alvir, Provocative tests with psychostimulant drugs in schizophrenia, „Psychopharmacology”, 91 (4), 1987, s. 415–433, DOI: 10.1007/BF00216006, PMID: 2884687 (ang.).
- Varsha J. Galani, Digvijay G. Rana, Depression and antidepressants with dopamine hypothesis-A review, „International Journal of Pharmaceutical Frontier Research”, 1 (2), 2011, s. 45–60 (ang.).
- O. Benkert i inni, Altered tyrosine daytime plasma levels in endogenous depressive patients, „Archives of General Psychiatry”, 25 (4), 1971, s. 359–363, DOI: 10.1001/archpsyc.1971.01750160071013, PMID: 5116991 (ang.).
- W Birkmayer, Linauer W, Storung D. Tyrosin and tryptophan- metabolisms in depression patients. „Arch Psychiar Nervenkr”. 213, s. 377–387, 1970 (ang.).
- M.B. Bowers, G.R. Heninger, F. Gerbode, Cerebrospinal fluid 5-hydroxyindoleacetic acid and homovanillic acid in psychiatric patients, „International Journal of Neuropharmacology”, 8 (3), 1969, s. 255–262, DOI: 10.1016/0028-3908(69)90046-x (ang.).
- Jeffrey N. Carlson i inni, Chronic antidepressant drug treatment reduces turning behavior and increases dopamine levels in the medial prefrontal cortex, „Brain Research”, 707 (1), 1996, s. 122–126, DOI: 10.1016/0006-8993(95)01341-5 (ang.).
- G.G. Nomikos i inni, Acute effects of bupropion on extracellular dopamine concentrations in rat striatum and nucleus accumbens studied by in vivo microdialysis, „Neuropsychopharmacology”, 2 (4), 1989, s. 273–279, PMID: 2482026 (ang.).
- Artykuł grupy psychiatrów amerykańskich na temat potencjału przyłączania się dopaminy do receptorów D2http://ajp.psychiatryonline.org/cgi/content/full/157/3/457
- F.R. Schneier i inni, Low dopamine D(2) receptor binding potential in social phobia, „The American Journal of Psychiatry”, 157 (3), 2000, s. 457–459, DOI: 10.1176/appi.ajp.157.3.457, PMID: 10698826.
W źródła wliczają się również przypisy i bibliografia wszystkich artykułów kategorii: "Neuroprzekaźniki" Wikipedii. Przeglądałem te źródła, tłumaczyłem ich fragmenty. Artykuł jest skondensowaną formą przekazania wiedzy zawartych w tych różnorodnych źródłach. Nad artykułem pracowałem ponad dwa tygodnie. Mam nadzieję, że będzie on Wam pomocny w przyswojeniu wiedzy na temat neuroprzekaźników:



Bardzo fajnie napisany artykuł. Jestem pod wrażeniem.
OdpowiedzUsuńZdecydowanie takie rzeczy są na pewno dość istotne, ale jeśli chodzi o mnie to wiem, że skorzystanie z właściwej pomocy psychologa jest czymś ważnym. Polecam na pewno psychologa od https://psycholog-ms.pl/zakres-pomocy/ i tak szeroki zakres pomocy jest w stanie pomóc wielu osobom.
OdpowiedzUsuń