HYDROKSYKWASY:
 1) Kwas abscysynowy - jest to organiczny związek chemiczny, fitohormon zaliczany do seskwiterpenów (węglowodorów z grupy terpenów - organicznych związków chemicznych o wzorze ogólnym (C5H8)n, których główny szkielet powstał w wyniku połączenia pięciowęglowych jednostek izoprenowych, dlatego liczba atomów węgla w cząsteczce terpenów jest podzielna przez pięć. Izoprenoidy zaliczane są w większości do lipidów;... do seskwiterpenów należą liczne składniki olejków eterycznych, żywic, mogą mieć strukturę łańcuchową lub cykliczną. Są oleistymi cieczami lub substancjami stałymi. Wyróżnia się tutaj laktony - składniki gorzkie; gorycze seskwiterpenowe i azuleny - lotne z parą wodnę, o niebieskiej barwie, zielonej, fioletowej, charakteryzują się właściwościami przeciwzapalnymi). Jest jedynym przedstawicielem tej klasy hormonów roślinnych, chociaż jego bezpośredni prekursor (ksantoksyna) także wykazuje niewielką aktywność biologiczną.
1) Kwas abscysynowy - jest to organiczny związek chemiczny, fitohormon zaliczany do seskwiterpenów (węglowodorów z grupy terpenów - organicznych związków chemicznych o wzorze ogólnym (C5H8)n, których główny szkielet powstał w wyniku połączenia pięciowęglowych jednostek izoprenowych, dlatego liczba atomów węgla w cząsteczce terpenów jest podzielna przez pięć. Izoprenoidy zaliczane są w większości do lipidów;... do seskwiterpenów należą liczne składniki olejków eterycznych, żywic, mogą mieć strukturę łańcuchową lub cykliczną. Są oleistymi cieczami lub substancjami stałymi. Wyróżnia się tutaj laktony - składniki gorzkie; gorycze seskwiterpenowe i azuleny - lotne z parą wodnę, o niebieskiej barwie, zielonej, fioletowej, charakteryzują się właściwościami przeciwzapalnymi). Jest jedynym przedstawicielem tej klasy hormonów roślinnych, chociaż jego bezpośredni prekursor (ksantoksyna) także wykazuje niewielką aktywność biologiczną.
Kwas abscysynowy może być syntetyzowany w roślinach na dwa sposoby:
a) w trakcie przemian szlaku kwasu mewalonowego, powstającego przez polimeryzację pirofosforanu izopentenylu (trzy jednostki izoprenowe). Kwas mewalonowy jest wówczas przekształcany do pirofosforanu farnezylu, z którego w wyniku utlenienia, cyklizacji i izomeryzacji do pozycji cis syntetyzowany jest kwas absyscysynowy.
b) poprzez oksydacyjną degradację karotenoidów. Związkiem rozpoczynającym cykl reakcji prowadzących do powstania kwasu absycysynowego jest wtedy wiolaksantyna. Droga syntezy jest zależna od tkanki i warunków środowiska.
Jego synteza odbywa się głównie w dojrzałych liściach i owocach, ale także w korzeniach, nasionach i owocach, lecz także w korzeniach, nasionach i pąkach. Wysoki poziom kwasu abscysynowego występuje w starzejących się tkankach oraz w roślinach rosnących w warunkach stresowych. W roślinie przemieszcza się głównie łykiem i w niewielkim stopniu drewnem. ABA ulega degradacji poprzez utlenienie jednej z grup metylowych w pozycji 6 i cyklizacji do kwasu fazeinowego. Stężenie ABA w tkankach regulowane jest także przez natężenie syntezy i tworzenie koniugatów z glukozą. Kwas abscysynowy hamuje wzrost objętościowy komórek; odpowiada za stan spoczynku nasion, jest inhibitorem kiełkowania; jest odpowiedzialny za tworzenie warstwy odcinającej podczas opadania liści, owoców, kwiatów; jest odpowiedzialny za przechodzenie roślin w stan spoczynku; powoduje zamykanie się aparatów szparkowych; przyspiesza procesy starzenia się tkanek; podwyższony poziom ABA jest reakcją roślin na stres, np. podczas braku wody ABA powoduje ograniczenie transpiracji, zwiększenie pobierania wody przez korzenie, a także indukowanie ekspresji genów rab oraz syntezę białek chroniących przed odwodnieniem. W rolnictwie ABA jest stosowany do wywoływania lub przyspieszania desykacji roślin.
HISTORIA ODKRYCIA: O istnieniu substancji warunkującej spoczynek nasion i pąków pędowych wiedziano wcześniej, jednakże dopiero w roku 1964 Frederick T. Addicott wyizolował z owoców bawełny substancję stymulującą tworzenie warstwy odcinającej i opadanie owoców. Wyizolowany związek został nazwany kwasem abscysynowym.
 2) Amfoterycyna B - jest to organiczny związek chemiczny pochodzenia naturalnego, antybiotyk przeciwgrzybiczy, wytwarzany przez bakterię z rodzaju Streptomyces. Zawiera pierścień makrocykliczny zbudowany z fragmentu polienowego oraz polihydroksylowego. Jest to skuteczny lek w walce z zakażeniami, pochodzącymi od Candida albicans (np. drożdżycy amerykańskiej), a także w niektórych grzybicach (np. histoplazmozie, kryptokokozie, grzybicy układu pokarmowego). Lek ten działa przez interakcję z ergosterolami błon komórek gospodarza. Efektem jest zaburzenie integralności błony komórkowej, co powoduje wypływ jonów potasowych, oraz innych składników wewnątrzkomórkowych, oraz napływ składników zewnątrzkomórkowych, co skutkuje lizą komórki. Poza tym amfoterycyna B powoduje wzrost wydzielania cytokin, oraz pobudza makrofagi do wytwarzania wolnych rodników.
2) Amfoterycyna B - jest to organiczny związek chemiczny pochodzenia naturalnego, antybiotyk przeciwgrzybiczy, wytwarzany przez bakterię z rodzaju Streptomyces. Zawiera pierścień makrocykliczny zbudowany z fragmentu polienowego oraz polihydroksylowego. Jest to skuteczny lek w walce z zakażeniami, pochodzącymi od Candida albicans (np. drożdżycy amerykańskiej), a także w niektórych grzybicach (np. histoplazmozie, kryptokokozie, grzybicy układu pokarmowego). Lek ten działa przez interakcję z ergosterolami błon komórek gospodarza. Efektem jest zaburzenie integralności błony komórkowej, co powoduje wypływ jonów potasowych, oraz innych składników wewnątrzkomórkowych, oraz napływ składników zewnątrzkomórkowych, co skutkuje lizą komórki. Poza tym amfoterycyna B powoduje wzrost wydzielania cytokin, oraz pobudza makrofagi do wytwarzania wolnych rodników.
3) Atorwastatyna - lek należący do grupy syntetycznych statyn (inhibitorów reduktazy HMG-CoA - grupy wielofunkcyjnych organicznych związków chemicznych, zarówno pochodzenia naturalnego, jak i syntetycznych, o różnej budowie chemicznej, mających w formie aktywnej wspólną grupę farmakoforową: łańcuch beta-hydroksykwasu). Jest wybiórczym inhibitorem reduktazy 3-hydroksy-3-metylo-glutarylo-koenzymu A (reduktazy HMG-CoA). Reduktaza HMG-CoA to enzym wątrobowy znajdujący się w cytoplazmie hepatocytów, regulujący ilość syntetyzowanego cholesterolu, a więc także wpływający (wraz z HDL) na jego poziom w osoczu. Enzym ten podlega kontroli poprzez jego fosforylację i defosforylację. W postaci ufosforylowanej jest on nieaktywny. Czynnikiem fosforylującym są kinazy aktywowane przez glukagon. Ekspresja genu kodującego ten enzym również może być hamowana przez egzogenny cholesterol oraz glukagon. W postaci zdefosforylowanej jest aktywny. Stan ten warunkowany jest insuliną, która również wzmaga ekspresję genu kodującego tę reduktazę. Innym mechanizmem kontroli jego aktywności jest sprzężenie zwrotne ujemne, to znaczy wzrost mewalonianu (produktu reakcji, którą katalizuje HMG-CoA) oraz cholesterolu powoduje degradację reduktazy HMG-CoA. W medycynie inhibitorami tego enzymu, a zatem inhibitorami syntezy cholesterolu, są leki z grupy STATYN, np. lowastatyna
ATORWASTATYNA HAMUJE KONWERSJĘ HMG-COA DO PREKURSORA STEROLI, MEWALONIANU HAMUJĄC SYNTEZĘ CHOLESTEROLU W WĄTROBIE. REZULTATEM JEST WIĘKSZA EKSPRESJA RECEPTORÓW DLA LDL (WZRASTA ICH ZAGĘSZCZENIE NA KOMÓRKACH) I WIĘKSZY WYCHWYT CZĄSTEK LDL. ZMNIEJSZA SIĘ STĘŻENIE CHOLESTEROLU CAŁKOWITEGO I CHOLESTEROLU LDL. DODATKOWO ZMNIEJSZA SIĘ RÓWNIEŻ STĘŻENIE CHOLESTEROLU VLDL, APOLIPOPROTEINY B I TRÓJGLICEYDÓW. W NIEWIELKIM STOPNIU ZWIĘKSZY SIĘ STĘŻENIE CHOLESTEROLU HDL.
Atorwastatyna dzięki swemu działaniu zmniejsza występowanie epizodów niedokrwiennych w okresie 16 tygodni po ostrym zespole wieńcowym i zmniejsza ryzyko incydentów sercowo-naczyniowych u osób z nadciśnieniem tętniczym i co najmniej 3 dodatkowymi czynnikami ryzyka naczyniowo sercowego.
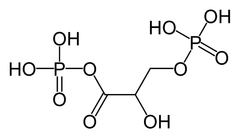 4) 1,3-Bisfosfoglicerynian - organiczny związek chemiczny biorący udział w glikolizie i cyklu Calvina. Pełni on funkcję związku przenoszącego energię, co związane jest z występowaniem wiązań wysokoenergetycznych, czyli wiązań labilnych, łatwo ulegających rozerwaniu.
4) 1,3-Bisfosfoglicerynian - organiczny związek chemiczny biorący udział w glikolizie i cyklu Calvina. Pełni on funkcję związku przenoszącego energię, co związane jest z występowaniem wiązań wysokoenergetycznych, czyli wiązań labilnych, łatwo ulegających rozerwaniu.  5) Kwas chenodeoksycholowy - jest to pierwotny kwas żółciowy syntetyowany z cholesterolu przez komórki wątrobowe, stosowany także jako lek. W połączeniu z glicyną lub tauryną tworzy sole żółciowe i w tejże postaci zostaje wydzielany do dróg żółciowych, a następnie do pęcherzyka żółciowego (gdzie wchodzi w skład żółci) i stąd do jelita cienkiego, gdzie bierze udział w trawieniu tłuszczów.
5) Kwas chenodeoksycholowy - jest to pierwotny kwas żółciowy syntetyowany z cholesterolu przez komórki wątrobowe, stosowany także jako lek. W połączeniu z glicyną lub tauryną tworzy sole żółciowe i w tejże postaci zostaje wydzielany do dróg żółciowych, a następnie do pęcherzyka żółciowego (gdzie wchodzi w skład żółci) i stąd do jelita cienkiego, gdzie bierze udział w trawieniu tłuszczów. 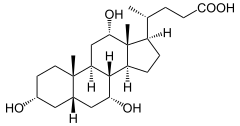 6) Kwas cholowy - jest to organiczny związek chemiczny z grupy steroidów. Pełni on ważną rolę jako jeden z kwasów żółciowych. Cząsteczka kwasu cholowego zawiera trzy grupy hydroksylowe i jedną grupę karboksylową. Sole kwasu cholowego nazywają się cholanami. Krystalizuje się go w postaci płytek o gorzkim smaku. Jest stosowany do produkcji leków.
6) Kwas cholowy - jest to organiczny związek chemiczny z grupy steroidów. Pełni on ważną rolę jako jeden z kwasów żółciowych. Cząsteczka kwasu cholowego zawiera trzy grupy hydroksylowe i jedną grupę karboksylową. Sole kwasu cholowego nazywają się cholanami. Krystalizuje się go w postaci płytek o gorzkim smaku. Jest stosowany do produkcji leków.
*Kwasy żółciowe to kwasy organiczne syntetyzowane w wątrobie, będące końcowymi produktami degradacji (rozkładu) endogennego (wewnątrzustrojowego) cholesterolu. Wśród związków steroidowych są one najlepiej rozpuszczalne w wodzie ze względu na obecność kilku hydrofilowych grup -OH oraz polarnej grupy karboksylowej. Ułatwiają rozpuszczanie się zawartego w żółci cholesterolu. Kwasy żółciowe są substancjami powierzchniowo czynnymi, mają zdolność zmniejszania napięcia powierzchniowego roztworów, a dzięki temu emulgowania tłuszczów i tworzenia szerokiej powierzchni dla rozwinięcie działalności lipazy trzustkowej - enzymu odpowiedzialnego za trawienie tłuszczów w jelicie (ponadto aktywują one ten enzym).
 |
| Źródło: Wikipedia. Związki zaliczane do ciał ketonowych od góry: aceton, kwas acetylooctowy, kwas beta-hydroksymasłowy. |
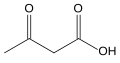
7) Ciała ketonowe - jest to grupa organicznych związków chemicznych, które są pośrednimi metabolitami tłuszczów. Należą do nich aceton (powstający w wyniku spontanicznej dekarboksylacji acetooctanu); kwas acetylooctowy (w formie anionu - acetylooctan); kwas beta-hydroksymasłowy (w formie anionu - beta-hydroksymaślan). U człowieka głównym miejscem produkcji i wydzielania do krwi ciał ketonowych jest wątroba. Zwykle skład procentowy wynosi: 75-80% kwasu beta-hydroksymasłowego; 20-25% kwasu acetylooctowego; poniżej 2% acetonu. Może on jednak ulegać zmianom. Ciała ketonowe są alternatywnym produktem utleniania wolnych kwasów tłuszczowych w wątrobie, zaś proces ich powstawania określa się terminem ketogeneza. Stężenie ciał ketonowych w surowicy u zdrowych osób pozostających na prawidłowej diecie nie przekracza 0,2 mmol/l. Mózg, serce, mięśnie i nerki potrafią wykorzystywać je jako materiał energetyczny, ale w prawidłowych warunkach, głównym wykorzystywanym materiałem jest glukoza. W pewnych warunkach metabolicznych dochodzi do zwiększenia produkcji ciał ketonowych. Najczęściej zachodzi to w cukrzycy przy znacznym niedoborze insuliny i może prowadzić do ketonemii i kwasicy ketonowej, a w zaawansowanych przypadkach do ketonowej śpiączki cukrzycowej. Stwierdzono, iż nadmierne stężenie ciał ketonowych we krwi jest spowodowane raczej zwiększoną ich produkcją aniżeli zmniejszoną przemianą w tkankach pozawątrobowych. Inne przypadki, kiedy dochodzi do zwiększonego produkowania ciał ketonowych to głodzenie, dieta niskowęglowodanowa, nadużywanie alkoholu, w ciąży przy ograniczeniu spożycia węglowodanów, w czasie znacznego wysiłku fizycznego u cukrzyków.
- Aceton - jest to związek chemiczny z grupy ketonów, najprostszy keton alifatyczny. Ma ostry, charakterystyczny zapach. Miesza się w każdych proporcjach z wodą, etanolem, eterami i innymi ketonami o niskiej masie cząsteczkowej. Aceton obecny jest w niewielkich ilościach w krwi i moczu. Większe od normy jego stężenie pojawia się w organizmie przy zaawansowanej i nieleczonej cukrzycy. Aceton jest naturalnie obecny w tkankach wielu roślin (np. ziemniaków, żyta), gazach wulkanicznych i gazach spalinowych. Tworzy się on w dużych ilościach w trakcie suchej destylacji drewna, która była niegdyś głównym sposobem jego produkcji. Obecnie w przemyśle produkuje się go najczęściej metodą kumenową przy okazji otrzymywania fenolu.

W laboratorium można go otrzymać poprzez suchą destylację octanu wapnia. Aceton wytwarzany jest efektywnie przez bakterie Clostridium acetobutylicum. Proces ten został opisany po raz pierwszy w latach 1904-1907, natomiast wykorzystany w praktyce do przemysłowej produkcji acetonu w roku 1915 przez brytyjskiego biochemika pochodzenia żydowskiego Chaima Weizmanna, późniejszego pierwszego prezydenta państwa Izrael. W okresie I wojny światowej występowało duże zapotrzebowanie na aceton, niezbędny składnik kordytu (rodzaj prochu bezdymnego), natomiast działania wojenne uniemożliwiały Wielkiej Brytanii import octanu wapnia, prekursora acetonu. Technologia opracowana przez Weizmanna umożliwiła produkcję acetonu na dużą skalę. Ponieważ pożywkę dla C. acetobutylicum przygotowywano z deficytowej kukurydzy, konieczne było przeniesienie produkcji do Kanady (1916) i USA (1917). Weizmann w zamian za swoje zasługi zasugerował swoje poparcie dla idei państwa żydowskiego w Palestynie, co w dużej mierze przyczyniło się do uchwalenia deklaracji Baifoura. Obecnie otrzymywany jest głównie na skalę przemysłową metodą kumenową z propylenu, a także katalitycznie z alkoholu izopropylowego, acetylenu w wyniku fermentacji butanolowo-acetonowej. Aceton jest powszechnie stosowanym rozpuszczalnikiem organicznym o dużej polarności. Rozpuszcza większość miękkich tworzyw sztucznych, lakiery, tłuszcze, oleje (nawet nagar silnikowy). Dobrze rozpuszcza się w nim acetylen, przez co używa się go w butlach na ten gaz w celu uniknięcia zbyt wysokiego ciśnienia, pod którym acetylen jest niestabilny. Stosuje się go przy produkcji leków, barwników, farb, lakierów, środków czyszczących. Jest często stosowany jako składnik zmywacza do paznokci. Aceton może być wykorzystywany jako prekursor do produkcji narkotyków.
- Kwas acetylooctowy - CH3-CO-CH2-COOH- jest to organiczny związek chemiczny, najprostszy beta-ketokwas. Występuje on w organizmie człowieka jako produkt pośredni metabolizmu tłuszczów. Łatwo ulega on rozkładowi do dwutlenku węgla i acetonu. Stosowany jest w syntezie do otrzymywania związków organicznych.
- Kwas 3-hydroksymasłowy - organiczny związek chemiczny z grupy hydroksykwasów, ciało ketonowe. Jako związek chiralny posiada dwa enacjomery kwas D-3-hydroksymasłowy i L-3-hydroksymasłowy. Substancja ta jest syntetyzowana w wątrobie z acetooctanu (powstałego z acetylo-CoA) i gdy stężenie glukozy we krwi jest niskie, może zostać użyta przez organizm jako źródło energii. Podczas kwasicy ketonowej stężenie kwasu 3-hydroksymasłowego we krwi wzrasta. Związek ten jest także używany do syntezy biodegradowalnych tworzyw sztucznych.

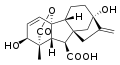 8) Kwas giberelinowy (GA3) - jest to wielofunkcyjny, wielopierścieniowy organiczny związek chemiczny. Wykazuje on aktywność biologiczną hormonu roślinnego, jednak nie stwierdzono jego wytwarzania w tkankach roślinnych. Kwas giberelinowy został wyizolowany w formie krystalicznej przez japońskich badaczy T.Yabutę i T.Sumiki w 1938 roku jako uboczny metabolit grzybowego patogenu roślinnego Gibberella fujikuroi powodującego nadmierny wzrost rośliny. Pierwotny produkt okazałs ię mieszaniną trzech związków, natomiast w 2003 roku znanych było już 130 kwasów giberelinowych określanych jako gibereliny.
8) Kwas giberelinowy (GA3) - jest to wielofunkcyjny, wielopierścieniowy organiczny związek chemiczny. Wykazuje on aktywność biologiczną hormonu roślinnego, jednak nie stwierdzono jego wytwarzania w tkankach roślinnych. Kwas giberelinowy został wyizolowany w formie krystalicznej przez japońskich badaczy T.Yabutę i T.Sumiki w 1938 roku jako uboczny metabolit grzybowego patogenu roślinnego Gibberella fujikuroi powodującego nadmierny wzrost rośliny. Pierwotny produkt okazałs ię mieszaniną trzech związków, natomiast w 2003 roku znanych było już 130 kwasów giberelinowych określanych jako gibereliny.
*GIBERELINY - są to związki będące zarówno właściwymi fitohormonami, jak i produktami ich przemian, zaliczane często do regulatorów wzrostu i rozwoju roślin. Gibereliny należące do fitohormonów regulują wzrost i dojrzewanie roślin. Najbardziej rozpowszechnioną gibereliną jest kwas giberelinowy (GA3).
 9) Kwas glikolowy (kwas hydroksyoctowy) - jest to organiczny związek chemiczny, najprostszy przedtawiciel alfa-hydroksykwasów. Jest bezbarwnym, bezwonnym, higroskopijnym ciałem stałym, bardzo dorbze rozpuszczalnym w wodzie. Jest używany do produkcji preparatów ochronnych skóry. Kwas glikolowy jest otrzymywany w reakcji kwasu chlorooctowego z wodorotlenkiem sodu, a następnie zakwasza się środowisko. Sumaryczna reakcja wygląda następująco:
9) Kwas glikolowy (kwas hydroksyoctowy) - jest to organiczny związek chemiczny, najprostszy przedtawiciel alfa-hydroksykwasów. Jest bezbarwnym, bezwonnym, higroskopijnym ciałem stałym, bardzo dorbze rozpuszczalnym w wodzie. Jest używany do produkcji preparatów ochronnych skóry. Kwas glikolowy jest otrzymywany w reakcji kwasu chlorooctowego z wodorotlenkiem sodu, a następnie zakwasza się środowisko. Sumaryczna reakcja wygląda następująco:
. Światowa produkcja sięga kilku tysięcy ton rocznie. Na dużą skalę kwas glikolowy otrzymuje
się w katalitycznej reakcji formaldehydu z gazem syntezowym. Można go także wyizolować ze źródeł
naturalnych, takich jak trzcina cukrowa, burak cukrowy, ananas, kantalupa (gatunek melona) czy winorośl.
Kwas glikolowy można także otrzymać w enzymatycznym procesie w którym powstaje mniej zanieczyszczeń,
w porównaniu do tradycyjnej metody, zużywa się mniej energii podczas produkcji oraz powstaje mniejsza ilość
współproduktów. Jednakże każdy z powyższych procesów może być dostosowany do relatywnie niskich
kosztów.
Dzięki bardzo dobrym zdolnościom do przenikania skóry, kwas glikolowy znajduje zastosowanie w produktach
ochrony skóry. Stosowany jest w celu polepszenia wyglądu skóry i jej tekstury. Powoduje zmniejszenie
zmarszczek, trądziku młodzieńczego oraz hiperkeratozy. Po zaaplikowaniu, kwas glikolowy, reaguje z górnymi
warstwami naskórka pobudzając właściwości wiążące lipidów które utrzymują martwe komórki naskórka razem.
Dzięki temu warstwa zrogowaciała naskórka złuszcza się, ukazując żywą skórę. Kwas glikolowy wysokiej czystości
dostępny jest komercyjnie jako środki higieny osobistej.
Kwas glikolowy jest także cennym półproduktem w syntezie organicznej, głównie w reakcjach redoks, estryfikacji,
polimeryzacji długołańcuchowej. Jest stosowany jako monomer kwasu poliglikolowego i innych biozgodnych
kopolimerów. Znajduje także zastosowanie w przemyśle tekstylnym jako środek barwiący oraz przy garbowaniu,
jako dodatek do żywności konserwant. Dodawany jest także do emulsji polimerów, dodatek do tuszów i farb.
Kwas glikolowy działa silnie drażniaco. Spożycie kwasu glikolowego jest także niebezpieczne, gdyż tak jak
glikol etylenowy jest on metabolizowany do kwasu szczawiowego.
10) Kwas 3-hydroksy-3-metylomasłowy - jest to pochodna kwasu 3-hydroksymasłowego. Stosowany jest w suplementach
dla sportowców, zwłaszcza kulturystów. Hydroksymetylomaślan należy do grupy tzw. zaawansowanych produktów proteolizy.
Powstaje naturalnie w efekcie katabolizmu białek. Jego prekursorem jest leucyna. W zasadzie wszystkie produkty
zaawansowanej proteolizy mają zdolnosć hamowania aktywności enzymów katabolicznych, z tym, że HMB jest z nich
najskuteczniejszy. Jak się przypuszcza, może to być związane z faktem, iż hydroksymetylomaślan dostarcza grup
metylowych do metylacji ubikwityny - procesu dezaktywacji najsilniejszego enzymu katabolicznego.
Związek ten odkrył w 1992 roku zespół pod kierunkiem Steve'a Nissena. Wg Nissena, pełni on nie do końca wyjaśnioną rolę w metabolizmie
odbudowy tkanki mięśniowej. Badania Nissena na koloniach komórkowych i zwierzętach zdawały się dowodzić, że spożywanie tego związku może zwiększać
odporność mięśni na zmęczenie i sprzyjać szybszemu przyrostowi tkanki mięśniowej, co spowodowało, że
zaczęto go stoswoać w suplementach dla sportowców. Badania te zostały jednak zakwestionowane przez dwa inne zespoły naukowe,
które mimo wielu prób nie potwierdziły skuteczności tego związku chemicznego jako czynnika znacząco wpływającego na wzrost
11) Kwas 4-hydroksybutanowy - jest to organiczny związek chemiczny z grupy hydroksykwasów karboksylowych. Występuje naturalnie w ludzkich
endogennej substancji, kwasu 3-hydroksybutanowego. Kwas 4-hydroksybutanowy przez wiele lat używany był jako anestetyk. Został on jednak zastąpiony
przez nowsze substancje o mniejszym potencjale nadużywania i mniejszej liczbie efektów ubocznych.
Związek ten stosuje się przy leczeniu alkoholizmu - do łagodzenia symptomów odstawiennych oraz jako środek wspomagający detoksykację organizmu.
Lek występuje pod nazwą handlową Alvocer. W latach 60. XX wieku używany był również do walki z bezsennością, jako lek przeciwdepresyjny, środek
dopingujący (przez sportowców). Pod handlową nazwą Xyrem, jest używany w leczeniu narkolepsji poprzez
zmniejszenie liczby ataków katapleksji (od gr. kata "pod, w dół" - wzmocnienie, i plessein - iderzyć, palnąć) - neurologicznych zaburzeń, będących nagłą,
krótkotrwałą i odwracalną utratą napięcia mięśniowego, które skutuje często osunięciem się chorego na ziemię. Objawia się ono również niespodziewanymi napadami snu
w ciągu dnia i wypadaniem przedmiotów z rąk. Jest objawem chorobowym nakolepsji, choć może być również wywołana silnymi emocjami takimi jak strach.
Kwas 4-hydroksybutanowy jest substancją psychoaktywną o działaniu euforyzującym, energetyzującym i rozweselającym.
Podnosi także libido i ułatwia kontakt z innymi osobami. Ze względu na mechanizm działania GHB zaliczane jest do
depresantów. Średnia dawka rekreacyjna waha się w przedziale 1,5-2,5g. Małe dawki (1-1,5g) powodują efekt podobny do alkoholu etylowego
- pobudzenie, poprawienie nastroju, intensyfikacja bodźców zewnętrznych. Większe dawki (2-3g) mogą powodować
euforię, rozweselenie, naernergetyzowanie, zniesienie zahamowań, większą towarzyskość, otwartość emocjonalną, ale także mdłości,
trudności z koordynacją, zawroty głowy. Ponadto GHB podobnie jak flunitrazepam znane jest jako pigułka
gwałtu. Duże dawki tej substancji (powyżej 4 gramów) mogą wywoływać amnezję i utratę świadomości. Ta właściwość kwasu
gamma-hydroksymasłowego wykorzystywana jest przez gwałcicieli. Dodatkowo alkohol etylowy wchodzi w interakcję
z GHB i powoduje zwiększenie liczby efektów ubocznych. Wykrycie GHB w krwi jest bardzo trudne lub niemożliwe, gdyż jego ostatecznymi
metabolitami są dwutlenek węgla i woda.
12) Kwas 3-hydroksymasłowy - jest to hydroksykwas, ciało ketonowe. Jako związek chiralny posiada dwa enacjomery - kwas D-3-hydroksymasłowy
 i L-3-hydroksymasłowy. Substancja ta jest syntetyzowana w wątrobie z acetooctanu (powstałego z acetylo-CoA) i gdy stężenie
i L-3-hydroksymasłowy. Substancja ta jest syntetyzowana w wątrobie z acetooctanu (powstałego z acetylo-CoA) i gdy stężenie
glukozy we krwi jest niskie, może zostać użyta przez organizm jako źródło energii. Podczas kwasicy ketonowej stężenie kwasu
3-hydroksymasłowego we krwi wzrasta. Związek ten jest także używany do syntezy biodegradowalnych tworzyw sztucznych.
przez nowsze substancje o mniejszym potencjale nadużywania i mniejszej liczbie efektów ubocznych.
Związek ten stosuje się przy leczeniu alkoholizmu - do łagodzenia symptomów odstawiennych oraz jako środek wspomagający detoksykację organizmu.
Lek występuje pod nazwą handlową Alvocer. W latach 60. XX wieku używany był również do walki z bezsennością, jako lek przeciwdepresyjny, środek
dopingujący (przez sportowców). Pod handlową nazwą Xyrem, jest używany w leczeniu narkolepsji poprzez
zmniejszenie liczby ataków katapleksji (od gr. kata "pod, w dół" - wzmocnienie, i plessein - iderzyć, palnąć) - neurologicznych zaburzeń, będących nagłą,
krótkotrwałą i odwracalną utratą napięcia mięśniowego, które skutuje często osunięciem się chorego na ziemię. Objawia się ono również niespodziewanymi napadami snu
w ciągu dnia i wypadaniem przedmiotów z rąk. Jest objawem chorobowym nakolepsji, choć może być również wywołana silnymi emocjami takimi jak strach.
Kwas 4-hydroksybutanowy jest substancją psychoaktywną o działaniu euforyzującym, energetyzującym i rozweselającym.
Podnosi także libido i ułatwia kontakt z innymi osobami. Ze względu na mechanizm działania GHB zaliczane jest do
depresantów. Średnia dawka rekreacyjna waha się w przedziale 1,5-2,5g. Małe dawki (1-1,5g) powodują efekt podobny do alkoholu etylowego
- pobudzenie, poprawienie nastroju, intensyfikacja bodźców zewnętrznych. Większe dawki (2-3g) mogą powodować
euforię, rozweselenie, naernergetyzowanie, zniesienie zahamowań, większą towarzyskość, otwartość emocjonalną, ale także mdłości,
trudności z koordynacją, zawroty głowy. Ponadto GHB podobnie jak flunitrazepam znane jest jako pigułka
gwałtu. Duże dawki tej substancji (powyżej 4 gramów) mogą wywoływać amnezję i utratę świadomości. Ta właściwość kwasu
gamma-hydroksymasłowego wykorzystywana jest przez gwałcicieli. Dodatkowo alkohol etylowy wchodzi w interakcję
z GHB i powoduje zwiększenie liczby efektów ubocznych. Wykrycie GHB w krwi jest bardzo trudne lub niemożliwe, gdyż jego ostatecznymi
metabolitami są dwutlenek węgla i woda.
12) Kwas 3-hydroksymasłowy - jest to hydroksykwas, ciało ketonowe. Jako związek chiralny posiada dwa enacjomery - kwas D-3-hydroksymasłowy
 i L-3-hydroksymasłowy. Substancja ta jest syntetyzowana w wątrobie z acetooctanu (powstałego z acetylo-CoA) i gdy stężenie
i L-3-hydroksymasłowy. Substancja ta jest syntetyzowana w wątrobie z acetooctanu (powstałego z acetylo-CoA) i gdy stężenieglukozy we krwi jest niskie, może zostać użyta przez organizm jako źródło energii. Podczas kwasicy ketonowej stężenie kwasu
3-hydroksymasłowego we krwi wzrasta. Związek ten jest także używany do syntezy biodegradowalnych tworzyw sztucznych.




Brak komentarzy:
Prześlij komentarz